- 作者 Aly W.
- 首次发表于 2019 年 7 月 1 日
- 最后修改于 2022 年 10 月 19 日
- 原文出处
- 译者 Bersella AI
- 翻译于 2022 年 3 月 2 日
- 修订于 2022 年 10 月 21 日
译者按
 免责声明:本文不构成任何医疗、处方建议。如有医疗需要,应于专业医师指导下进行。
免责声明:本文不构成任何医疗、处方建议。如有医疗需要,应于专业医师指导下进行。- 因译者能力所限,部分术语之翻译或有纰漏,烦请指正。
摘要
醋酸环丙孕酮(CPA)是一种孕激素与抗雄制剂,广泛用于女性化激素治疗。其作为孕激素的作用,远甚于作为雄激素受体拮抗剂的作用。一般作为孕激素用于顺性别妇女时,其剂量介乎 1~2 mg/天;作为抗雄制剂时,其剂量介乎 50~300 mg/天。但对于后者,会有强烈的孕激素过量影响,以及与之关联的副作用和风险。
CPA 因其孕激素作用可抑制睾酮水平,故也有拮抗促性腺激素之效应。单服 CPA 时,睾酮水平最大可压制 50% 至 70%;而结合小剂量雌激素服用时,其可完全抑制来自性腺的睾酮分泌,并将睾酮水平降低约 95%——正好落入女性范围。尽管历史上曾有女性倾向跨性别者每日服用 50~100 mg 的 CPA,但目前已知的是,5~10 mg/天的剂量足以最大程度(或接近最大程度)抑制睾酮水平。
CPA 本身通常以 50 mg/片的形式提供。这些片剂可被切药器切开,之后每日或隔日服用一次,这样日均剂量可减至 6.25 至 12.5 mg。低剂量 CPA 不仅可显著减少开销,而且有更好的耐受性及安全性。出于其低剂量仍保持的效用、以及和剂量相关的风险之考量,针对女性倾向跨性别者的 CPA 临床用量正在快速减少。
前言
本文讨论醋酸环丙孕酮(CPA)的剂量。CPA 是一种孕激素与抗雄制剂,用于女性倾向跨性别者的激素治疗。本文探讨了以更低剂量服用 CPA,并深入论证了低剂量的合理性。
如果读者只对推荐剂量感兴趣,可见推荐剂量一节。
CPA 之效力、传统剂量与健康风险
CPA 是一种强效孕激素,在顺性别妇女身上,1 mg/天的剂量即可抑制排卵,1~3 mg/天即可使子宫内膜转化 (维基百科; 表格; Endrikat et al., 2011)。该剂量的 CPA 之效力,相当于处在黄体期的绝经前妇女自然产生的孕酮量(25 mg/天)以及孕酮水平(15 ng/mL)之效力。当作为孕激素用于顺性别妇女时(例如作为避孕药,或更年期激素疗法制剂),CPA 以每片 1/2 mg 的形式提供。
和其孕激素效力相反,CPA 作为雄激素受体(AR)拮抗剂之效力弱得多(维基百科)。作为抗雄制剂,其剂量一般介乎 50~300 mg/天,对于顺性别男女皆如此。对于女性,一般使用 50~100 mg/天以改善受雄激素影响的皮肤与毛发之状况(例如痤疮与多毛症);而对于男性,则一般使用 100~300 mg/天以治疗前列腺癌(若伴随手术/药物阉割,则使用 100~200 mg/天;单服 CPA 疗法则需 200~300 mg/天)(维基百科))。为此,CPA 一般被制成 50mg 或 100mg 的片剂以供服用 (维基百科))。CPA 作为抗雄制剂有双重机制:通过其低剂量下的孕激素作用来抑制睾酮水平,高剂量下还可直接阻止睾酮作用于 AR。
CPA 因其孕激素效力远甚于 AR 拮抗剂效力,使用传统临床剂量会有强烈的孕激素过量影响。有三篇文献摘录描述了这点:
CPA 与其前身醋酸氯地孕酮相似,皆为强效孕激素,在 20~30 mg 剂量下即可使子宫内膜转化。……
CPA 每个月为完全达到临床上的雄激素拮抗效果所需剂量的生理效力,应相当于一个月经周期内所产生孕酮之效力的三十倍。CPA 尽管是 (抗雄) 这方面最有用的药物,但并非是理想的抗雄制剂,尤其是,某些副作用还与孕激素的过量摄入有关(而非其雄激素拮抗效应)。……
在需要 CPA 完全发挥雄激素拮抗效应的场合,产生的诸如疲倦、无力、体重增加等不良反应皆可能与严重过量摄入的孕激素之效力有关。 (Hammerstein et al., 1975)
Fixson (1963) 在已摘除卵巢、且事前服用了雌激素的妇女身上试用 CPA;20~30 mg 的剂量可使子宫内膜转化,这说明其为一种强效孕激素。对于月经推迟的试验,其有效剂量不明,但估计应低于 1mg/天(Miller and Jacobs 1986)。
相比于孕激素效力,CPA 的雄激素拮抗效应应被认为相当羸弱;为完全发挥该效应,需要每日服用 100mg,这相当于用于月经周期转化的剂量之三倍(Hammerstein and Cupceancu 1969)(值得一提的是,该数值相当于整个月经周期中黄体分泌的孕酮总量)。 (Hammerstein, 1990)
在内分泌学性质上,CPA 应具有较强的孕激素效力以及有限的雄激素拮抗效力。……
关于其孕激素活性,每月(每周期)需要 20-30 mg 以转化受雌激素驱动(oestrogen-primed)的子宫内膜,该剂量和醋酸氯地孕酮以及其它强效孕激素相似。为完全发挥雄激素拮抗效力,每日须至少服用 50-100 mg 的 CPA,此剂量相当于女性在整个月经周期的孕酮暴露量的两到三倍。必须承认,这种孕激素的摄入已严重过量,除非大幅减少其用量以及效力。……
已有人指出,CPA 并非一种有利于内分泌平衡的药物成分,因为其孕激素效力显著优于雄激素拮抗效力。有一种方法可以避免伴随高剂量反向序贯疗法而生的孕激素的严重过量:就是合并使用低剂量的避孕药和一种纯抗雄制剂(例如游离的环丙孕酮)。……
必须强调的是,CPA 远不是一种用于多毛症的抗雄疗法的理想药物,因为其孕激素效力过强,局部作用也并不佳。因此,在未来值得为此寻找平衡性更好的抗雄制剂。 (Hammerstein, 1979)
因高剂量 CPA 导致的孕激素摄入的高度过量,以及 CPA 高剂量下产生的已知不良反应与风险之间,存在一定关联(维基百科)。这些副作用包括:疲倦、抑郁、体重增加、高泌乳素水平(维基百科)、良性脑膜瘤(Aly W., 2020; 维基百科; 表格 1; 表格 2)、血栓(维基百科)以及心血管问题(维基百科)等。这些风险和剂量相关;迄今未发现每日 1/2 mg 的 CPA 与此存在关联(但有一项例外,即合用炔雌醇时会提高血栓风险)。CPA 的肝毒性同样与剂量相关:一般当剂量超过 20 mg/天时,肝转化酶水平会有升高;若超过 100 mg/天,有罕见概率出现肝衰竭(维基百科; 表格)。低剂量能够尽量减少风险,这就是为何使用尽可能少的 CPA 的根本所在。
历史上,曾有女性倾向跨性别者每日服用 50~100 mg 的 CPA。但在 2017 年,美国内分泌学会发布了最新一版针对跨性别者激素治疗的临床实践指南,其中将 CPA 的推荐用量从 50~100 mg/天降至 25~50 mg/天(Hembree et al., 2017; Hembree et al., 2009)。此举可能是受到了日渐明了的高剂量 CPA 之风险的驱动。不过,新的推荐用量似乎仍远超实际所需。
低剂量或高剂量 CPA 对睾酮的抑制
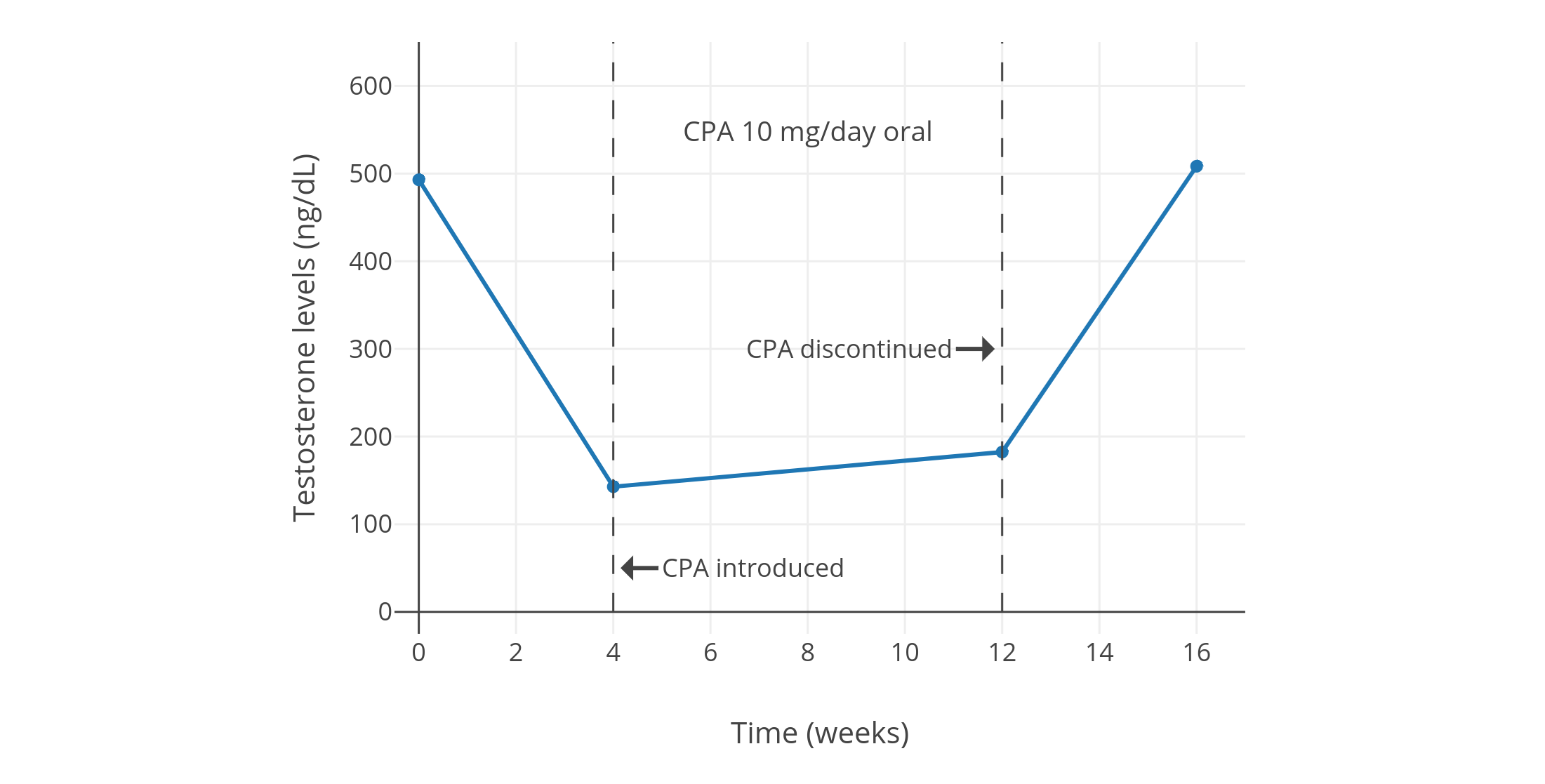
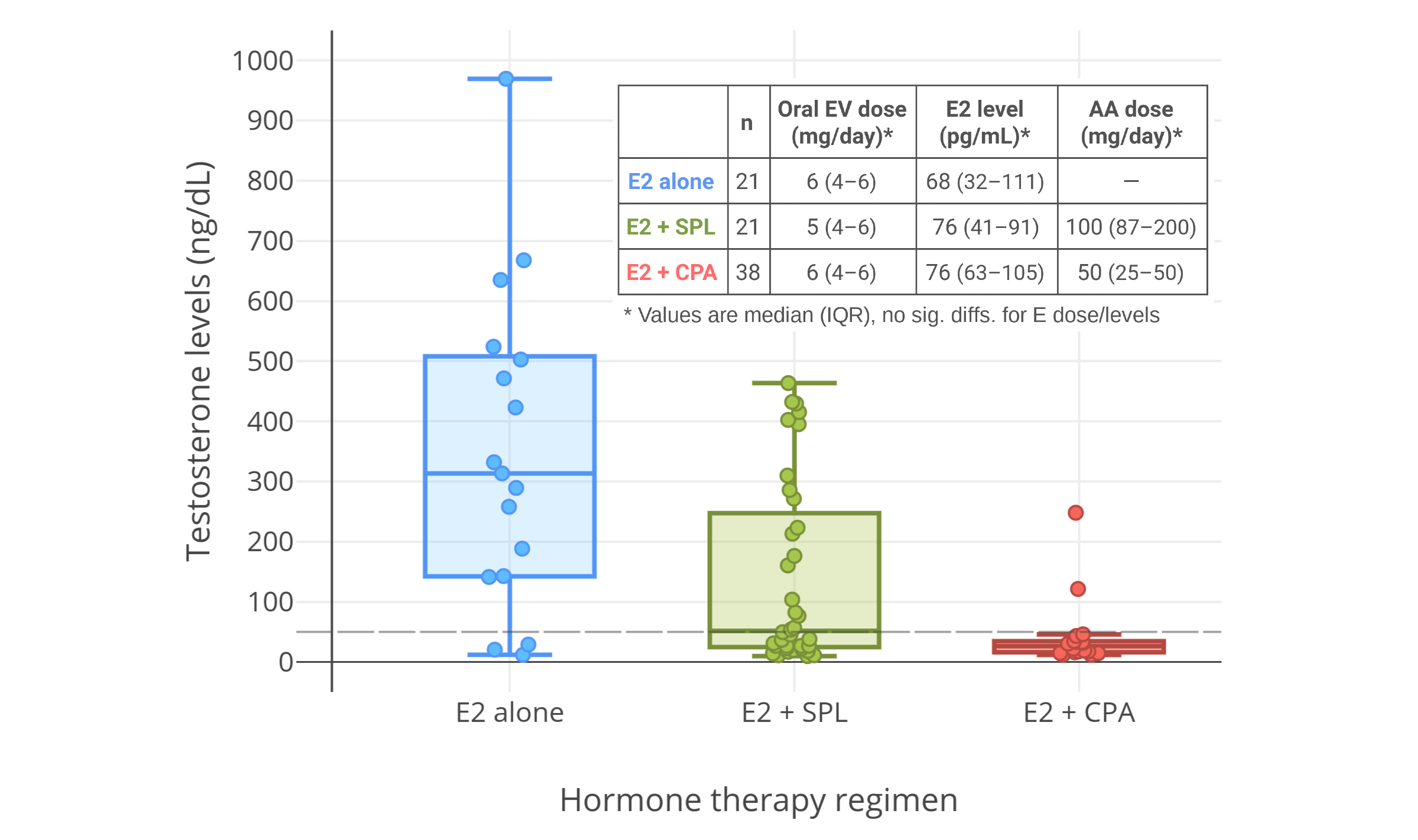
像 CPA 一类的孕激素,可以显著抑制出生指派性别为男、性腺完整的人群当中的睾酮水平。从 1970 年代到 1980 年代初发表的一系列规模较小、质量较低的研究项目发现,健康年轻男性每日服用 5~10 mg 的 CPA,可将睾酮水平抑制 40~70%。其中,一些项目报告了使用 5 mg/天剂量的睾酮抑制程度,和使用 10 mg/天剂量的几乎一致(皆抑制了约 50%;图表);而 10 mg/天剂量的效果则与 20 mg/天相近(皆为约 60~70%;图表)。同一项目里即使 CPA 剂量加倍,也未能提高睾酮抑制率,这表明实际仅需 5 或 10 mg/天的 CPA 剂量,即可最大程度抑制睾酮。一项在 2002 年进行的、使用更现代和更可靠的血清睾酮定量方法的研究项目,发现了 10 mg/天用量的 CPA 可将睾酮水平抑制 66%(从约 600±150 ng/dL 压减至约 185 ng/dL;但未提供标准差数据)(Meriggiola et al., 2002a)。
【多图表】男性单服低剂量 CPA 期间的睾酮水平。最下方的图表来自上述 2002 年的研究项目,使用了时间分辨荧光分析法(DELFIA)以测定睾酮水平。该项目还研究了不同剂量的地诺孕素(DNG);其仅需 1 mg/天剂量即可抑制排卵,这点与 CPA 相似。
有关其它孕激素之研究项目——诸如去氧孕烯、地诺孕素、醋酸氯地孕酮等,也同样发现:在男性身上可最大程度抑制睾酮水平的剂量,约为妇女抑制排卵所需剂量的 5~10 倍(维基百科 1; 2; 3)。基于后者一般使用 1 mg/天的认知,可以认为 5~10 mg/天剂量的 CPA 即可将睾酮的抑制效果最大化。该范围也与上述项目之发现相吻合。
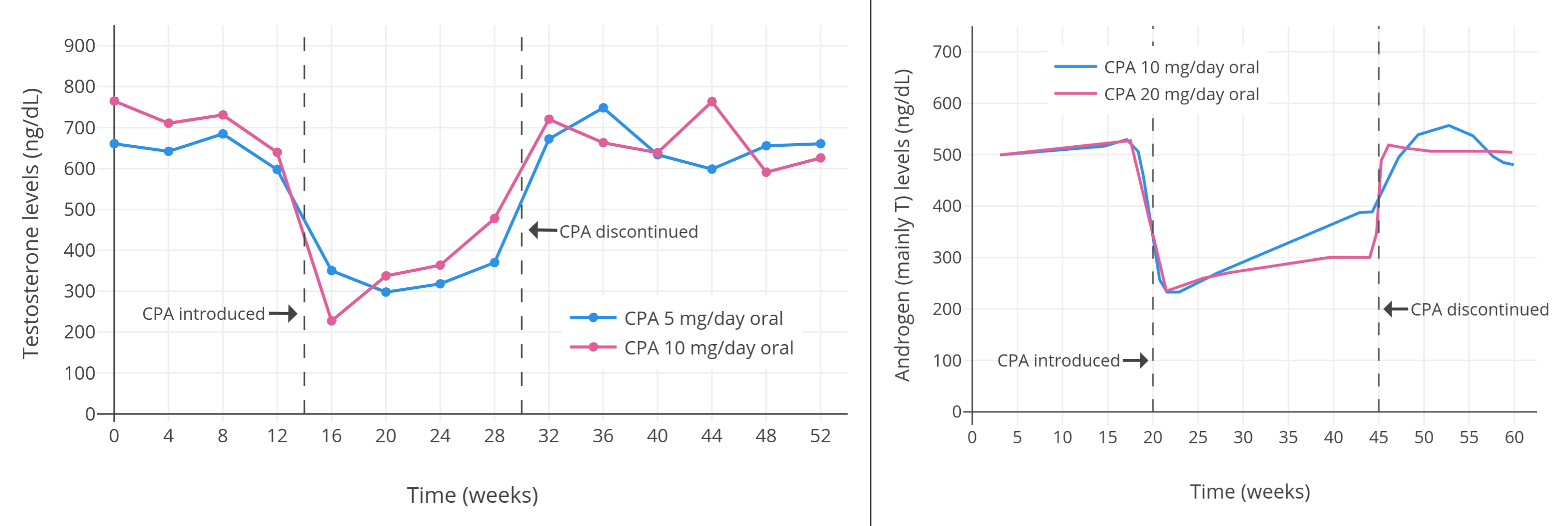
有关更高剂量 CPA 的研究项目则发现,高剂量下睾酮的抑制效果,仅略优于低剂量的表现。近年来一些针对健康的青春期及青年女性倾向跨性别者的研究项目,发现在单服 50~100 mg/天的 CPA 的情况下,睾酮水平被抑制了 46~61%(在 4~12 个月内,从 456–602 ng/dL 降至 226–294 ng/dL)。(Toorians et al., 2003; Giltay et al., 2004; T’Sjoen et al., 2005; Tack et al., 2017)
针对患有前列腺癌的老年人群的研究则发现,单服高剂量 CPA 疗法——每日服用 50~100 mg——可最多将睾酮水平抑制 70~80%(降到了 50–200 ng/dL)。(Gräf, Brotherton, & Neumann, 1974; Jacobi et al., 1980 - 相关图表; Knuth, Hano, & Nieschlag, 1984 - 相关图表; Schröder & Radlmaier, 2002; Nelson, 2011)
之所以在前列腺癌患者身上测出了更大的睾酮抑制率,可能是因为不同项目之间验血方法有所区别,以及/或者老年人群的 HPG 轴功能更弱、从而使睾酮水平更低。(Liu, Takahashi, & Veldhuis, 2017; Winters, Wang, & Fortigel Study Group, 2010)
目前已有人发现,长期使用单服孕激素疗法,会发生睾酮水平的“复原”或“逃逸”现象:尽管 (前期) 其在最大有效剂量下即被显著抑制,但最终会逐渐回升。迄今该现象已在醋酸甲地孕酮上得到验证(维基百科);在 CPA 上亦有证实(Goldenberg & Bruchovsky, 1991; Saborowski, 1987; Jacobi, Tunn, & Senge, 1982)。其中一项研究显示,睾酮水平起初被抑制了 70% 左右;但在第 6~12 个月疗程中,其回升至 50% 左右,并在此后至多 24 个月内维持稳定。采用单服孕激素疗法抑制睾酮时,需要关注到睾酮的逃逸现象。不过,迄今尚未发现合用雌激素与孕激素疗法与此现象存在关联。
与雌激素合用时对睾酮的抑制作用
女性倾向跨性别者一般会将 CPA 与雌激素合用。雌激素同样可抑制睾酮水平。二者合用时,可产生抑制睾酮的协同作用,其剂量相较单服雌激素或孕激素时也更少。 (如果单用雌激素,) 要将睾酮抑制到和经外科手术(即睾丸切除术)、或经药物(即 GnRH 拮抗剂)阉割相一致的水平,则要求相对较高的雌激素水平。当雌二醇浓度处在 200~300 pg/mL 范围,其可抑制睾酮水平达 90% 左右(降至平均 50 ng/dL);如提高到 500 pg/mL 左右,则睾酮抑制率可达 95%(平均达 15 ng/dL)(维基百科; 图表)。由于需要超生理剂量的雌二醇方可最大程度(或接近最大程度)抑制睾酮,因此,往往采用低剂量雌二醇结合抗雄制剂/孕激素的方式来替代。
在 1980 和 1990 年代,针对前列腺癌患者的临床研究发现,将高剂量孕激素(例如每日服用 100~300 mg 的 CPA、或 40~160 mg 的醋酸甲地孕酮)结合低剂量雌激素(例如每日服用 0.1~0.2 mg 的己烯雌酚、或 0.5~1.5 mg 的雌二醇)使用,可完全抑制性腺分泌睾酮,并将睾酮水平减至阉割后的范围(小于 50 ng/dL)(Geller et al., 1981a; Geller et al., 1981b; Geller & Albert, 1983; Goldenberg et al., 1988; Johnson et al., 1988; Geller, 1988; Venner et al., 1988; Geller, 1991; Bruchovsky, 1991; Bruchovsky et al., 1993; Goldenberg et al., 1996)。这里有一篇文献摘录对此做了详述:
如前所述,CPA 并未完全抑制血浆睾酮浓度:其被抑制了 70% 左右,但数值仍相当于阉割后浓度的三倍。为系统研究该问题,Rennie 等 (59) 调查并对比了 12 种睾酮除去法。他们发现,将 CPA 与极低剂量的乙烯雌酚(0.1 mg/天)合用,可高效去除雄激素(例如血浆睾酮、组织内的双氢睾酮)。该团队 (60,61) 随后还发现,每日 200mg、甚至 100mg 的 CPA 足以获得相似的内分泌反馈,这也和其第二阶段临床治疗的相当正面的反馈具有关联性。出于内分泌学的视角,这项研究法不仅具有较多潜在优势,而且逻辑性很强:这种给药方案可结合两种制剂的抗雄效果;仅需少量雌激素,即可将血浆睾酮水平降低至经过阉割的程度。一旦睾酮达到阉割后水平,只需少量 CPA 即可中和剩余雄激素(主要来自肾上腺)的作用。在第三阶段疗程里,并未将合用低剂量 CPA 及乙烯雌酚的疗法,与常规疗法进行比较。考虑到内分泌反馈与观察结果,二者合用的疗法应该具有相对其它常规疗法的竞争力。(Schröder & Radlmaier, 2002)
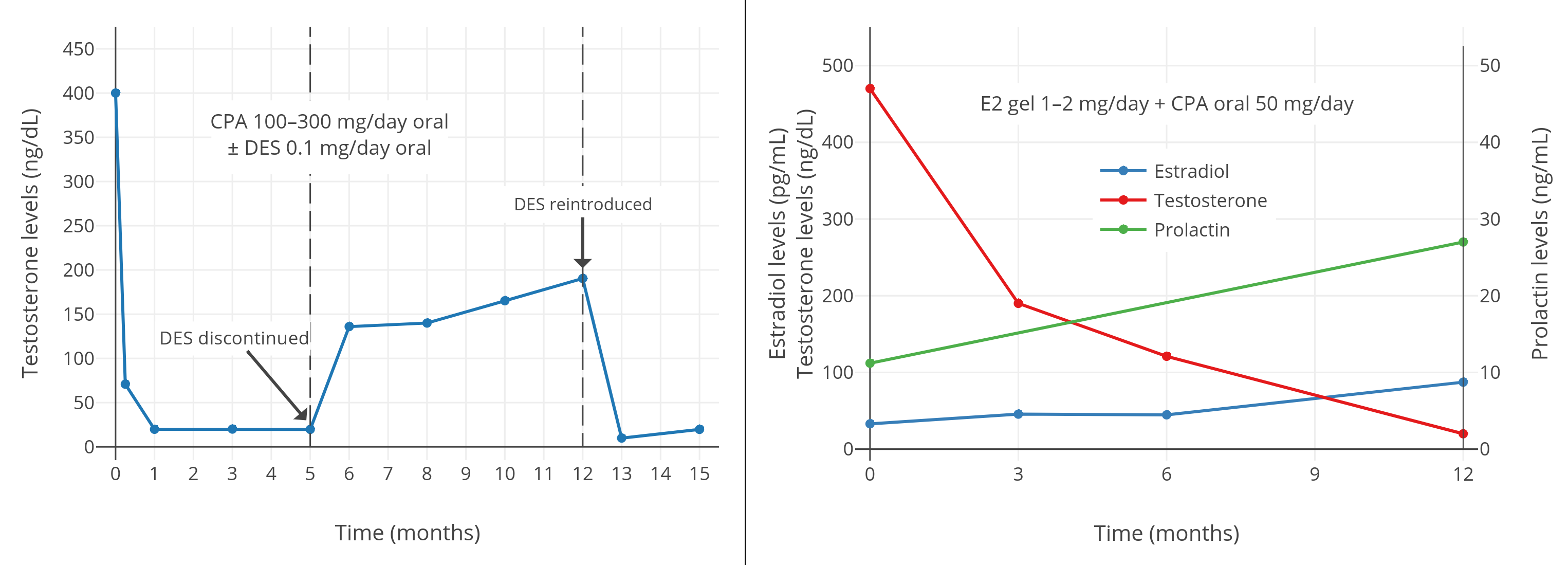
一项 2016 年的研究发现,在每日服用 50 mg 的 CPA、并涂抹 1~2 mg 雌二醇透皮凝胶的女性倾向跨性别者当中,45 pg/mL 左右的雌二醇水平(结合 CPA)并不足以抑制睾酮到女性/阉割后范围;其睾酮水平约为 120~190 ng/dL(Gava et al., 2016; 图表)。不过,85 pg/mL 左右的雌二醇水平(结合 CPA)则完全抑制了性腺的睾酮分泌,最终睾酮水平约在 20 ng/dL。因此,结合 CPA 来完全抑制睾酮所需的雌二醇浓度,需达到一个特定最小值。
另一项在 2019 年进行、针对口服 CPA 与戊酸雌二醇的女性倾向跨性别者的研究显示,完全抑制睾酮水平所需的雌二醇浓度,中位数为 76 pg/mL,第 25 百分位数为 63 pg/mL(Angus et al., 2019; 图表)。
【多图表】男性、女性倾向跨性别者合用 CPA 与低剂量雌激素时的睾酮浓度。右上图附注:透皮雌二醇平均剂量在第 6~12 个月有所提升。
Fung 等人 (2017) 发现,女性倾向跨性别者结合 25/50 mg 每日的 CPA 与口服雌二醇(约 3.5 mg/天)或透皮雌二醇(约 3.5 mg/天的凝胶,或约 100 μg/天的贴片)使用,可完全、一致地抑制性腺的睾酮分泌,睾酮水平被抑制约 95%(Fung, Hellstern-Layefsky, & Lega, 2017)。该剂量的雌二醇被认为可达到平均 100 pg/mL 的雌二醇水平(Aly W., 2020; 维基百科)。Fung 等人 (2017) 的研究恰巧比美国内分泌学会的 2017 年版《指南》早发布六个月;该研究可能是促使后者所推荐的 CPA 剂量减少的原因(从 50~100 mg/天降至 25~50 mg/天)。
迄今罕有研究了结合低剂量 CPA 与中、低剂量雌激素对睾酮之抑制的项目。不过,基于单服 5~10 mg/天的 CPA 已可最大程度抑制睾酮的事实,可以认为其效果与高剂量的类似。根据部分研究,结合使用 5~12.5 mg/天的 CPA 与用于生理替代的睾酮的健康年轻男性,已检测不出促性腺激素(小于 0.5 IU/L),睾丸功能因此被完全抑制(Meriggiola et al., 1998; Meriggiola et al., 2002b)。雌二醇的促性腺激素拮抗效应,相对睾酮也更强(维基百科),因此这些发现或许也适用于结合 CPA 与用于生理替代的雌二醇的情况(例如平均 100~200 pg/mL 的雌二醇浓度)。
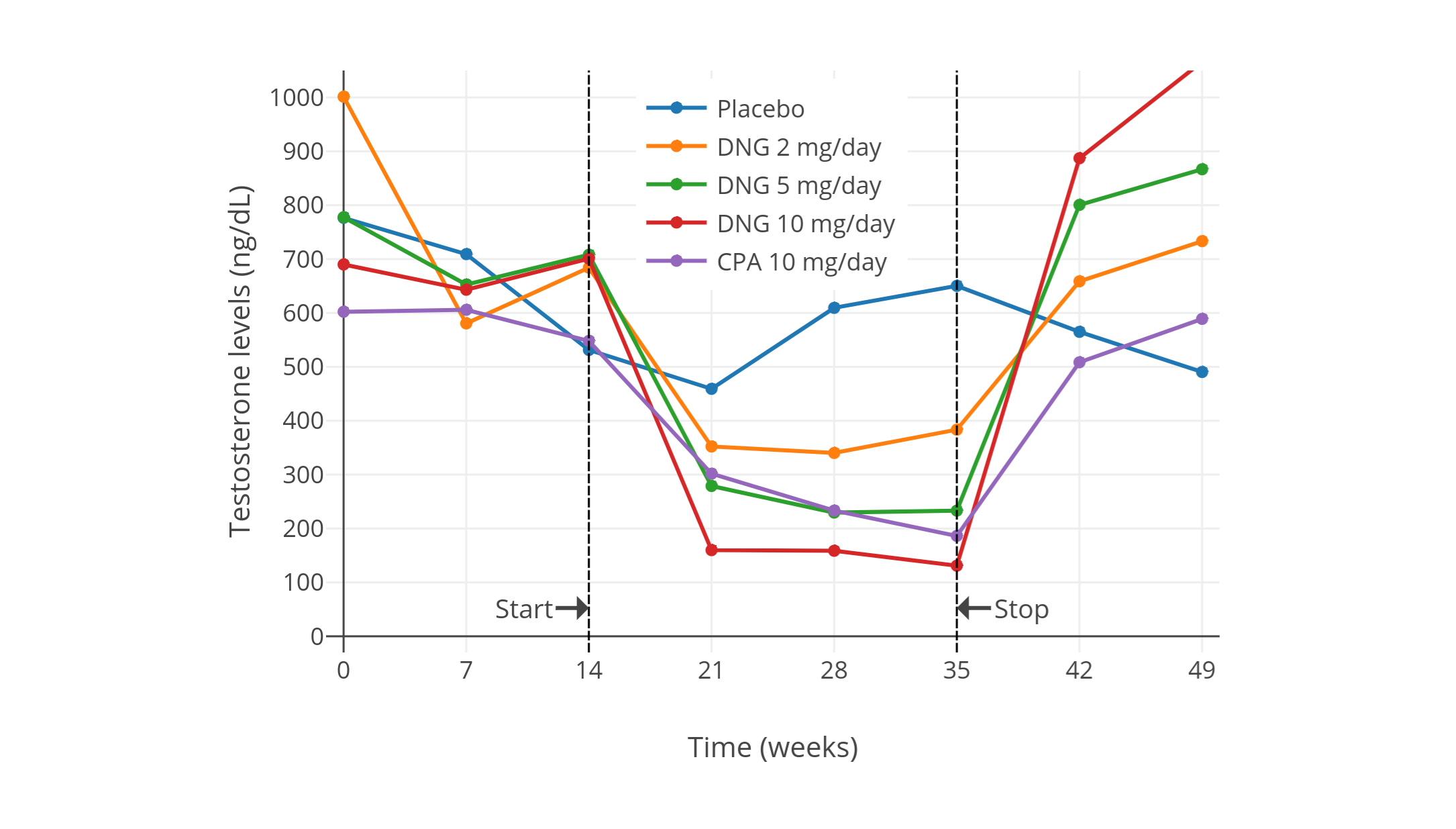
依据 Meyer 等人 (2020) [PDF] 对 155 名女性倾向跨性别者合用 CPA 与雌二醇进行的研究,10、25、50 mg/天剂量的 CPA 并未在睾酮水平上形成差异;三者皆达到较高抑制率(平均降至 15–20 ng/dL,落入女性正常范围的下限)。其中所用雌二醇形态包括:戊酸雌二醇口服片(剂量范围 3–10 mg/天、中位数 6 mg/天),以及雌二醇透皮贴片(100 μg/天)。雌二醇浓度平均达 100 pg/mL;而四分位间距(即第 25、第 75 百分位之差)则可达 100 pg/mL 左右。该研究表明,对于女性倾向跨性别者,如果其雌二醇水平合适,仅需不超过 10 mg/天的 CPA 即可完全抑制睾酮水平。
另一项研究也发现,女性倾向跨性别者使用小于 20 mg/天、和大于 50 mg/天的 CPA,在睾酮抑制率上无任何区别(Even-Zohar et al., 2020)。
在雌二醇水平合适的情况下,为抑制睾酮甚至仅需低于 5 mg/天剂量的 CPA(例如 2 mg/天),然而尚无任何研究予以证实。不过,这种概念在对其它孕激素的研究中已有先例。例如,在一项研究里,女性倾向跨性别者每日服用 10 mg 的醋酸甲羟孕酮(该剂量大致相当于可抑制绝经前妇女排卵的 CPA 剂量:1 mg/天(表格)),其睾酮水平下降了 63%,达 215 ng/dL(相比之下,雌二醇—螺内酯联合疗法可达 79 ng/dL)(Jain, Kwan, & Forcier, 2019)。因此,可以期望极低剂量的 CPA 也能达到类似效果;而且,这种剂量还具有将人体孕激素暴露量减至正常生理水平的益处。
更低剂量 CPA 的临床应用
考虑到高剂量 CPA 的风险、以及其低剂量下较强的睾酮抑制能力,临床上低剂量 CPA 正更多地被用于女性化激素治疗。许多文献证实了这点,其中向女性倾向跨性别者推荐了更少的剂量(例如: Lederbogen, 2009; Fung, Hellstern-Layefsky, & Lega, 2017; Heath & Wynne, 2019; Winkler-Crepaz et al., 2017; Mahfouda et al., 2018; Oliphant et al., 2018; Athanasoulia-Kaspar & Stalla, 2019; Bourns, 2019; Fuss et al., 2019; Jacobeit, 2019; Nota, den Heijer, & Gooren, 2019; 澳洲与新西兰临床试验登记系统, ANZCTR, 2020; Meyer et al., 2020 [PDF]; T’Sjoen et al., 2020)。其中,Nota, den Heijer, & Gooren (2019) 的文章将 CPA 推荐的、最低必要剂量定为 10~50 mg/天,该剂量与先前过大的推荐及使用剂量(100 mg/天)(Asscheman & Gooren, 1993; Gooren, Giltay, & Bunck, 2008)形成了鲜明反差。
更高剂量 CPA 的雄激素受体拮抗效应
CPA 的雄激素受体(AR)拮抗效应相对较弱。为达到有意义、或明显的 AR 拮抗效果,每日需服用 50~300 mg。但很不幸,该剂量造成了孕激素的严重过度摄入,继而存在与更高风险及更多不良反应的关联。因此,不宜再推荐使用这种剂量。基于合理的角度,CPA 应仅作为孕激素,以较低剂量来抑制睾酮水平。例如,可最大程度抑制睾酮的 CPA 剂量,大约在 10 mg/天或以下;适宜女性倾向跨性别者的最大剂量,应接近该数值。(不过,一天 12.5 mg 的剂量亦可接受。)
需要强调的是:将 CPA 结合雌激素使用,可将睾酮水平轻松抑制到女性、或阉割后范围(往往还低于 女性平均水平),因此并不需要伴随 AR 拮抗作用。无论如何,如果仍需要、或期望通过 AR 拮抗作用来中和剩余的处在女性、或阉割后水平的睾酮(例如治疗顽固痤疮、或有其它目的),可以在 CPA 之外再补充少量非孕激素类 AR 拮抗剂,例如比卡鲁胺、螺内酯等,这些相对高剂量 CPA 而言更为安全。
CPA 的推荐剂量
抑制睾酮所需剂量
如结合雌激素使用:
对于女性倾向跨性别者,下表所示 CPA 剂量足以最大程度抑制睾酮水平:
| 剂型 | 最小剂量 | 最大剂量 | 用法 |
|---|---|---|---|
| 10 mg 片剂 | 5 mg/天 | 10 mg/天 | 每日半片到一片 |
| 50 mg 片剂 | 6.25 mg/天 | 12.5 mg/天 | 每日 ⅛ 到 ¼ 片 |
最初一个月内,仅使用最小剂量。一个月过后,测量睾酮水平以确认其是否处在女性、或阉割后范围(小于 50 ng/dL)。如要完全抑制睾酮,需同时让雌二醇水平至少达到 65 pg/mL 左右(无关 CPA 剂量)。如果一个月后睾酮未被充分抑制、而雌二醇水平已足够,那么将 CPA 剂量加至最大推荐量,过一个月再测量睾酮水平。不过,作为替代,也可增加雌二醇用量;雌二醇水平越高,睾酮抑制率更佳。
如单服 CPA:
不建议单服 CPA 以抑制睾酮;因为其存在骨质疏松风险,以及其它由性激素缺乏引起的症状(维基百科; Aly W., 2019)。无论如何,单服的推荐剂量基本等同于上述合用雌激素时的用量。不过,略高的剂量(10~12 mg/天)不失为一种更好的选择。
孕激素作用所需剂量
对于女性倾向跨性别者,下表所示 CPA 剂量基本与通常的孕激素生理暴露量(即排卵期内孕激素水平)相似:
| 剂型 | 剂量 | 用法 |
|---|---|---|
| 10 mg 片剂 | 2.5 mg/天 | 每日 ¼ 片 |
| 50 mg 片剂 | 3.125 mg/天 | 每日 1/16 片 |
一些补充
在合用 CPA 与雌激素治疗时,作为理想之举,应通过采血来测量睾酮水平,以确保其被充分抑制。
可以使用切药器来切割 CPA 片剂。另外,还可每过 2 日或 3 日服用一次 CPA(而非每日服用),这样可平摊日均剂量。有一点需要补充:CPA 的清除半衰期较长,一般为 1.5~2 日,最长可达 4 日(维基百科; 图表)。因此,隔日服用、甚至每 3 日服用一次,是有市场的,也完全合情合理。
如果已经用 CPA 与雌激素压制睾酮到了女性、或阉割后水平,但仍期望通过 AR 拮抗作用来中和剩余睾酮;那么可以补充少量 AR 拮抗剂,例如比卡鲁胺(6.25~25 mg/天)或螺内酯(100~200 mg/天)。
后记
后记一
澳大利亚昆士兰大学的 Judith Dean 博士,正进行一项名曰 GoLoCypro 的研究(2019-2022 年)。该项目会评估 120~350 名女性倾向跨性别者合用 CPA 与雌二醇时,不同 CPA 剂量(每周两次 12.5 mg,隔日 12.5 mg,以及每日 12.5 mg、25 mg、50 mg)所产生的影响。CPA 剂量会被滴定到一个可维持睾酮水平在 0.5~1.5 nmol/L(14~43 ng/dL)的临床目标范围内的最小值。该项目是第一个研究女性倾向跨性别者使用不同剂量 CPA 的课题;其提供的有关可充分抑制睾酮的 CPA 最小剂量的宝贵资料亦备受关注。
后记二
2021 年 7 月,欧洲性别不一致调查组织网络(European Network for the Investigation of Gender Incongruence, ENIGI)在线发表了一篇有关女性倾向跨性别者使用低剂量 CPA 的研究论文:
- Kuijpers, S. M., Wiepjes, C. M., Conemans, E. B., Fisher, A. D., T’Sjoen, G., & den Heijer, M. (2021).
Toward a lowest effective dose of cyproterone acetate in trans women: Results from the ENIGI study.
The Journal of Clinical Endocrinology & Metabolism, 106(10), e3936–e3945. [DOI:10.1210/clinem/dgab427]
该项目结合使用了雌二醇与 CPA,所用剂量如下:
- 雌二醇: 戊酸雌二醇片(每日口服 2-6 mg)、贴片(50-150 μg/天)、凝胶等;
- CPA: 不服用(0 mg/天)、10 mg/天、25 mg/天、50 mg/天、100 mg/天。
在不服用 CPA 的实验组,睾酮的抑制并不充分;而所有服用 CPA 的实验组皆达到完全、且一致的睾酮抑制效果。结果如下:
| CPA 剂量 | 不服用 | 10 mg/天 | 25 mg/天 | 50 mg/天 | 100 mg/天 |
|---|---|---|---|---|---|
| 初始受试者人数 | 34 | 4 | 234 | 599 | 11 |
| 提高剂量的人数 | 16 | 1 | 11 | 2 | 0 |
| 降低剂量的人数 | 0 | 0 | 4 | 40 | 7 |
| 睾酮水平(nmol/L) | 5.5 | 0.9 | 0.9 | 1.1 | 0.9 |
| 睾酮水平(ng/dL) | ~160 | ~26 | ~26 | ~32 | ~26 |
| 检出睾酮低于 2 nmol/L 次数占比 | 46.3% | 92.3% | 96.2% | 93.4% | 100% |
该项目并未提供受试者总人数,以及调整 CPA 剂量之后的验血结果。因此,10 mg/天实验组的实际人数与验血结果并不可靠。不过,基于以上“检出睾酮低于 2 nmol/L 次数占比”的数据,该实验组的验血次数应当至少有 13 次(92.3% 大致等于 12/13,但也可能是 24/26,以此类推)。论文作者考虑到该组别人数/验血次数较少,也作出了解释:
本项目是属于 ENIGI 倡议之下的一项前瞻性群组研究。项目中为跨性别女性(trans women)所用的主要医疗方案,是每日结合使用雌激素与 50 mg 的 CPA。在实验的第一年,一些参与者使用每日 100 mg 的 CPA 剂量。此后不久,其处方调整为每日 50 mg 的 CPA。鉴于近年出现的越来越多的有关 CPA 的健康担忧,CPA 剂量后来又从 50 mg 减至 25 mg、10 mg。然而,受冠状病毒 (COVID-19) 疫情影响,来自 10 mg/天剂量组的参与者的结果,只有少量可用于分析。
该项目还发现,除了睾酮抑制率之外,在泌乳素与高密度脂蛋白(胆固醇)浓度上,10 mg/天剂量 CPA 的影响要小于高剂量。该项目也评估了肝转化酶水平,但未发现不同剂量之间有差异。
论文作者总结如下:
总而言之,对于这组跨性别女性群体,10 mg/天的 CPA 被发现足以将睾酮浓度降低至在顺性别妇女测出的范围内。该剂量 CPA 不仅和高剂量同样有效,而且对泌乳素浓度的影响更小,也能维持更高的高密度脂蛋白(胆固醇)水平。
尽管相较 CPA,选择长期副作用更少的 GnRH 拮抗剂更佳;但如果 GnRH 拮抗剂有使用禁忌、无法获取、或者无法报销(reimbursed)的情况,那么依据本项目的发现,低剂量 CPA 也不失为一种选项。
将来的研究重点,应该放在对更小剂量 CPA(例如 5 mg)之效力的评估、以及其潜在的长期副作用上。
围绕该论文的观点,论文作者之一:Guy T’Sjoen 及其他同行还在一篇对女性倾向跨性别者而言最佳的激素疗法之论述中,推荐 CPA 剂量应不高于 10 或 12.5 mg/天,且不应持续服用超过两年(Glintborg et al., 2021)。值得一提的是,T’Sjoen 其人被视为跨性别医学方面首屈一指的专家之一;他也是美国内分泌学会《跨性别护理指南》的联名作者之一(Hembree et al., 2017)。
在 Kuijpers 及其同行发表论文后不久,以色列的 Even Zohar 及其同行也于 2021 年 7 月,发表了一篇有关女性倾向跨性别者使用低剂量 CPA 的研究论文(其最初在 2020 年 5 月,作为会议摘要发表):
- Even Zohar, N., Sofer, Y., Yaish, I., Serebro, M., Tordjman, K., & Greenman, Y. (2021).
Low-Dose Cyproterone Acetate Treatment for Transgender Women.
The Journal of Sexual Medicine, 18(7), 1292–1298. [10.1016/j.jsxm.2021.04.008] - 会议摘要:Even-Zohar et al., 2020
在该论文的前言部分,有如下叙述:
为协助医师对跨性别女性(transgender women)进行治疗,一些组织已发布了《治疗指南》。CPA 已被广泛用于给药方案当中。总的来说,近年来 CPA 的推荐剂量已在减小:在美国内分泌学会 2009 年版《指南》当中,CPA 推荐剂量为 50-100 mg/天;但到了 2017 年,该剂量修订为 25-50 mg/天。而在澳大利亚跨性别健康专业协会的 2019 年版《指南》所建议的 CPA 剂量,为 12.5-25 mg/天。至于由欧洲性医学会发布的 2020 年版《指南》,则将 CPA 剂量修订为 10-50 mg/天。迄今尚无有关不同 CPA 剂量的效力与安全性之间的对比数据的论文发表。
该论文的研究者发现,当合用雌二醇时,低剂量 CPA(10-20 mg/天)的睾酮抑制率与高剂量(50-100 mg/天)一致。睾酮水平降低到了(或接近)女性/阉割后范围(一般不大于 2 nmol/L 或 58 pg/mL)。
有 38 名女性倾向跨性别者服用低剂量 CPA,其中 32 名(84%)的剂量为 10 mg/天、6 名(16%)的剂量为 20 mg/天,平均剂量 11.6 ± 3.7 mg/天。雌二醇则通过透皮贴片(平均剂量 83.7 ± 36.5 μg/天)、透皮凝胶(平均剂量 3.8 ± 1.2 g/天)或者口服(平均剂量 4.1 ± 1.7 mg/天)的形式给药。后续在低剂量、高剂量 CPA 组别当中,雌二醇浓度平均达到了约 110 到 350 pmol/L(或 ~30–95 pg/mL)。
除睾酮抑制效果之外,研究还发现了:在 12 个月激素治疗过后,低剂量 CPA 组别的泌乳素水平(398 ± 69 mIU/mL)显著低于高剂量的水平(804 ± 121 mIU/mL)。
基于这些发现,论文作者叙述如下:
我们建议,现有的《临床实践指南》应修订其为跨性别女性推荐的 CPA 剂量。
这两篇论文皆声明,其为首次揭露女性倾向跨性别者服用低剂量 CPA 之疗效。不过,这项成就其实应该属于 Meyer 等人 (2020) [PDF];其于 2020 年 2 月便已发现,女性倾向跨性别者合用雌二醇与 10、25、50 mg/天的 CPA 时,可获得一致的睾酮抑制效果。
Lim 等人 (2020) 在 2020 年 5/7 月发表了一篇论文;其研究课题并非与 CPA 及睾酮抑制效果有关,不过,其报告了 26 名女性倾向跨性别者分别使用口服与透皮雌二醇时,睾酮水平中位数(范围)分别为 0.6 (0.4–1.0) nmol/L、0.9 (0.7–1.6) nmol/L;她们还分为了合用雌二醇与低剂量 CPA(12.5-18.8 mg/天,中位数 12.5;共 14 人)、摘除性腺后单用雌二醇(共 9 人)、以及合用雌二醇与螺内酯(共 3 人)等组别。
后记三
一篇于 2021 年 12 月发表的论文报告了一起由低剂量 CPA 引起的致命肝衰竭病例:
- Kumar, P., Reddy, S., Kulkarni, A., Sharma, M., & Rao, P. N. (2021).
Cyproterone acetate induced Acute liver failure: Case report and review of the literature.
Journal of Clinical and Experimental Hepatology, 11(6), 739–741. [DOI:10.1016/j.jceh.2021.01.003]
该病例描述了一名 30 岁顺性别妇女连续六个月服用 25 mg/天的 CPA 以治疗多毛症,但患上了急性肝衰竭;住院四天后不治身亡。这是迄今报告的第二起和低于 100 mg/天剂量的 CPA 之肝毒性有关的病例,也是第一起有关 CPA 对于顺性别妇女之肝毒性的病例。该病例表明,在肝毒性上,即便相对较低的 CPA 剂量:25 mg/天,也并非足够安全。
该论文还强调了女性倾向跨性别者应使用最低有效剂量(不大于 10-12.5 mg/天)之重要性。
后记四
2022 年 9 月,世界跨性别人士健康专业协会(WPATH)发布了第八版《跨性别及性别多元化人群健康护理标准》(SOC),其中首次为跨性别激素治疗提供建议(Coleman et al., 2022)。其向女性倾向跨性别者推荐的 CPA 剂量为 10 mg/天(Coleman et al., 2022)。此剂量远比早前发布的《跨性别护理指南》所建议的要低;这也是首次有主流《指南》推荐如此低的剂量。
该《标准》提及了 Kuijpers 等人 (2021) 并支持其推荐的剂量[但并未提及 Even Zohar 等人 (2021) 与 Meyer 等人 (2020)],同时还讨论了脑膜瘤和高泌乳素水平等与 CPA 剂量有关的风险(Coleman et al., 2022)。
考虑到 WPATH 的这篇《标准》在跨性别健康领域的重要地位和影响力,可以认为,全球范围内在女性化激素治疗当中使用低剂量 CPA 的情况将会更普遍。有当下公认的循证实践在先,不应再继续使用高剂量 CPA。
后记五
2022 年 10 月,一项对雌二醇与 CPA 的睾酮抑制效果进行细致评估的研究,公开发表了论文:
- Collet, S., Gieles, N., Wiepjes, C. M., Heijboer, A. C., Reyns, T., Fiers, T., Lapauw, B., den Heijer, M., & T’Sjoen, G. (2022).
Changes in serum testosterone and adrenal androgen levels in transgender women with and without gonadectomy.
The Journal of Clinical Endocrinology & Metabolism, advance online publication. [DOI:10.1210/clinem/dgac576]
该项目属于欧洲性别不一致调查组织网络(ENIGI)倡议之下的一部分,其中大多数患者来自荷兰阿姆斯特丹的诊所、以及比利时根特的诊所。
该项目中有 275 名女性倾向跨性别者接受雌二醇合并 CPA 治疗。她们的总睾酮、游离睾酮水平,以及由肾上腺分泌的雄激素——脱氢表雄酮(DHEA)、硫酸脱氢表雄酮(DHEA-S)与雄烯二酮(A4)等——之水平,以液相色谱-质谱联用法(LC-MS)进行测定;测定时间定于跟踪开始时、第 3 个月、第 12 个月、第 2-4 年以及经手术切除性腺之后(此时不再服用 CPA)。至于其雌二醇水平,则以 LC-MS(阿姆斯特丹方面)或免疫测定法(根特方面)进行测定。
其所用雌二醇形式与剂量,通常为 4 mg/天的口服戊酸雌二醇或 100 μg/天的雌二醇透皮贴片;而 CPA 的剂量多为 25-50 mg/天。
这些人当中有大约一半,在以激素治疗约两年之后都接受了性腺切除术。
结果显示:
- 在不同跟踪时长下,以 LC-MS 和免疫测定法测定的雌二醇水平中位数,分别为 49-75 pg/mL(合 180–275 pmol/L)和 63-69 pg/mL(232–255 pmol/L)。
- 在接受激素治疗达三个月之后,总睾酮水平从 536 ng/dL (18.6 nmol/L) 降至 12 ng/dL (0.40 nmol/L),降幅 97.1%;而游离睾酮水平从 109 pg/mL (378 pmol/L) 降至 2.0 pg/mL (7.1 pmol/L),降幅 98.3%;此后,总睾酮、游离睾酮水平维持稳定。
- 至于 DHEA、DHEA-S 及 A4 等激素的水平,降幅则分别达 24.9-28.0%、20.1-23.5% 及 36.5%,到了激素治疗第 3-12 月之后也基本不变。
- 接受性腺切除术并停用 CPA 之后,并未出现睾酮水平的变化。
论文作者指出,在本研究中,接受激素治疗的女性倾向跨性别者的睾酮水平,与顺性别妇女接近或稍低于之。