女性倾向跨性别者的激素治疗简介
译者按
 免责声明:本文不构成任何医疗、处方建议。如有医疗需要,应于专业医师指导下进行。
免责声明:本文不构成任何医疗、处方建议。如有医疗需要,应于专业医师指导下进行。-
本文旨在对与女性化激素治疗(FHT)有关的各方面进行全方面介绍及科普,形式上与诸权威机构发表的跨性别健康护理指南相似,因此全文篇幅很长(译文共计约 2.4 万个汉字),需耐心阅读。
关于激素替代疗法(HRT)的简略说明可见 https://MtF.wiki 主站。
- 因译者能力所限,部分术语之翻译或有纰漏,烦请指正。
摘要
性激素由性腺产生,包括雌激素、睾酮和孕酮。性激素影响第二性征的发展;其中,睾酮引起男性化,而雌二醇引起女性化和乳房发育。男性有大量的睾酮,而女性有少量的睾酮和大量的雌二醇;这些激素差异造成了男女间身体上的不同。
女性倾向跨性别者使用性激素和其他激素类药物,将激素状况从男性典型转变成女性典型;这可引起女性化、去男性化并缓解性别焦虑。女性化激素治疗引起改变的时间从数月到数年不等。
有许多不同类型的激素药物,其可以通过不同的途径进行给药;例如,口服的丸/片剂、外用的贴片和凝胶、及注射剂等。不同的激素药物、途径和剂量具有不同的疗效、副作用、风险、开销及便利性。激素治疗时应定期通过血检进行监测,以确保疗效和安全,并在需要时作出调整。
性激素介绍
性激素种类和效果
人类性激素包括雌激素 (E)、孕激素 (P)和雄激素。一个人出生时所携带的性腺决定了其激素状况 (hormonal profile) ;出生时男性有睾丸,女性则有 卵巢。睾丸产生大量雄激素和少量雌激素,而卵巢则产生大量雌激素、孕酮与少量雄激素。
人体内的主要雌激素是雌二醇 (E2),主要孕激素是孕酮 (P4),主要雄激素是睾酮 (T) 和双氢睾酮 (DHT)。性激素引起并决定第二性征。它们通过作为 激动剂 (激活剂)作用于细胞内的受体而发挥作用;这些受体包括雄激素受体 (AR)、雌激素受体 (ER)和 孕激素受体 (PR)。激活后,这些受体调节基因表达以影响细胞和组织。
各激素的作用如下:
除了对身体的影响外,性激素在大脑中也有作用,影响认知、情绪和行为。例如,雄激素在男性中产生明显的 性欲 和 性唤醒 (包括 自发勃起),而雌激素是负责女性性欲的主要激素 (Cappelletti & Wallen, 2016)。性激素对健康也有积极或消极的重要影响;例如,雌激素可以保持骨骼强度,并可能防止顺性别妇女患 心脏病,但也会增加乳腺癌及血栓的风险(Aly, 2020)。
雌激素、孕激素和雄激素还有抗促性腺激素的作用——其可抑制 促性腺激素释放激素 (GnRH) 诱导的 促性腺激素[即促黄体激素 (LH) 和 促卵泡激素 (FSH) ]从大脑垂体中的分泌。促性腺激素向性腺发出信号,使其制造性激素并提供生育所需的精子和卵细胞。因此,促性腺激素水平的降低将导致性腺性激素分泌的减少和生育能力的降低。如果促性腺激素水平被充分抑制,性腺将完全不再制造性激素,生育能力将停止。
体内绝大部分的雌二醇、睾酮和孕酮是由性腺产生的。其余少量的这些激素大部分是由 肾上腺 产生的,其位于 肾脏 顶部。
正常激素水平
对于顺性别妇女,其性激素在童年期很少;到童年晚期和青春期时,性激素产量逐渐上升;到成年期则按周期规律变化;围绝经期之后,性激素产量大幅下滑。
在成年绝经前妇女的正常月经周期当中,尽管不同的激素水平变化很大,但其规律可以预测。一个月经周期平均持续约 28 天,包括以下阶段:
-
卵泡期 —— 周期的前半段或第 1-14 天
-
周期中段 —— 周期中间或第 12-16 天左右
-
黄体期 —— 周期的后半段或第 14-28 天
月经周期中的激素水平如下图所示:
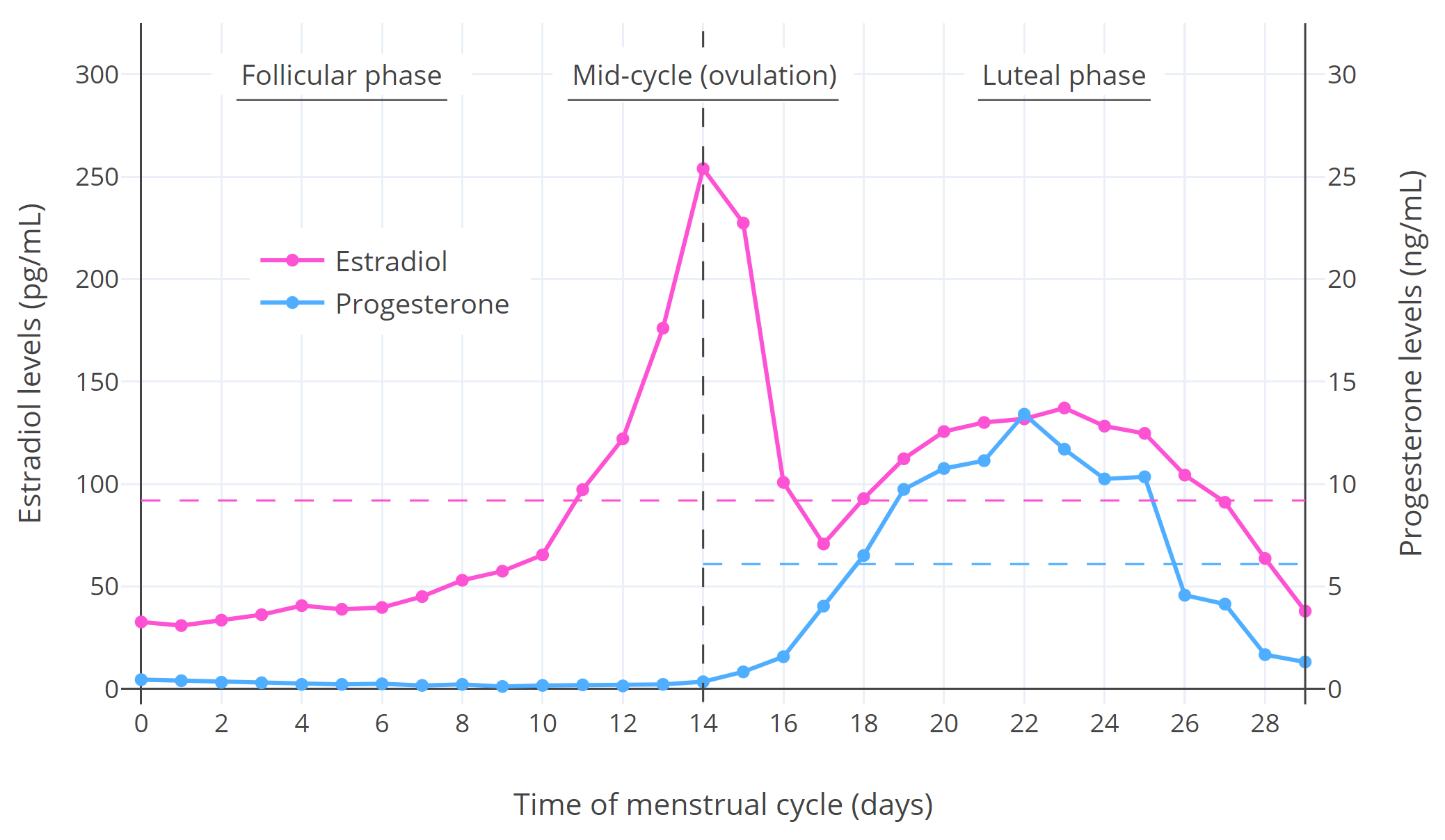
图 1:绝经前妇女整个月经周期的雌二醇和孕酮中位数水平 (Stricker et al., 2006; Abbott, 2009)。横向虚线为周期中段前后的平均水平。关于个体之间的差别可于他处查阅(图表1; 图表2; 图表3)。
如图 1 所示,在卵泡期,雌二醇水平相对较低,孕激素水平则非常低;在周期中段,雌二醇水平短暂激增至非常高的水平并触发 排卵 ,孕酮则维持不变;在黄体期,雌二醇和孕酮水平都经历了一个波动的过程,也相对较高(尽管雌二醇没有周期中段高峰时那么高)。
下表显示了(顺性别)女性和男性的雌二醇、孕酮和睾酮的血清水平和生产率,并可在它们之间进行比较。
表 1:主要性激素的血清水平(1)和生产速率估计值的区间(2):
| 激素 |
群体 |
时间 |
水平(单位体积质量)(3)
|
水平(摩尔浓度)(3)
|
生产速率 |
| 雌二醇 |
女性(4)
|
卵泡期 |
5–180 pg/mL |
20–660 pmol/L |
30–170 μg/天(5)
|
|
|
周期中段 |
45–750 pg/mL |
170–2,750 pmol/L |
320–950 μg/天(5)
|
|
|
黄体期 |
20–300 pg/mL |
73–1100 pmol/L |
250–300 μg/天(5)
|
|
男性 |
– |
8–35 pg/mL |
30–130 pmol/L |
10–60 μg/天 |
| 孕酮 |
女性(4)
|
卵泡期 |
≤0.3 ng/mL |
≤1.0 nmol/L |
0.75–5 mg/天 |
|
|
周期中段 |
0.1–1.5 ng/mL |
0.3–4.8 nmol/L |
4 mg/天 |
|
|
黄体期 |
3.5–38 ng/mL |
11–120 nmol/L |
15–50 mg/天(6)
|
|
男性 |
– |
≤0.5 ng/mL |
≤1.6 nmol/L |
0.75–3 mg/天 |
| 睾酮 |
女性(4)
|
整个月经周期 |
5–55 ng/dL |
0.2–1.9 nmol/L |
190–260 μg/天 |
|
男性 |
– |
250–1100 ng/dL |
8.7–38 nmol/L |
5–7 mg/天 |
(1) 激素水平数据来源如下(Zhang & Stanczyk, 2013; Nakamoto, 2016; Styne, 2016; LabCorp, 2020)。
(2) 生产率数据来源如下(Aufrère & Benson, 1976; Powers et al., 1985; Lauritzen, 1988; Carr, 1993; O’Connell, 1995; Kuhl, 2003; Norman & Henry, 2015a; Norman & Henry, 2015b; Strauss & FitzGerald, 2019)。
(3) 使用 液相色谱-质谱联用法(LC–MS;目前最先进的验血手段)。
(4) 在绝经前成人的月经周期中 (年龄约 18–50 岁)。
(5) 整个月经周期的雌二醇平均生产率约为 200 μg/天 或 6 mg/月 (Rosenfield, Cooke, & Radovich, 2021)。
(6) 黄体期孕酮的生产率平均约 25 mg/天 (Carr, 1993)。
绝经前妇女的平均雌二醇水平约为 100 pg/mL(合 367 pmol/L),男性则为 25 pg/mL(合 92 pmol/L);至于妇女平均雌二醇水平的第 95 百分位范围,则为 50-250 pg/mL(180-918 pmol/L)(例如 Abbott, 2009, 图表; Verdonk et al., 2019, 图表)。而绝经前妇女整个月经周期(即一个月)内由卵巢分泌的雌二醇平均约有 6 mg(Rosenfield et al., 2008);这相当于 200 μg/天的平均产出速率。女性在正常经历青春期时,雌二醇水平会缓慢上升,同时发生乳房发育与女性化过程。在青春期不同阶段,平均雌二醇水平都相当之低——直至后期也仍低于 50-60 pg/mL(180-220 pmol/L)左右(Aly, 2020)。
而当妇女绝经后,其卵巢不再分泌大量雌激素,此时雌二醇水平一般低于 10-20 pg/mL(37-73 pmol/L)(Nakamoto, 2016)。已知成人围绝经期症状与低于 50 pg/mL(184 pmol/L)的雌二醇水平相关;这些症状包括潮热、抑郁情绪、去女性化(如乳房萎缩,脂肪分布女性化程度降低等)、皮肤老化加速、以及骨质流失(增加骨折风险)等。
至于睾酮水平,绝经前妇女平均约为 30 ng/dL(1.0 nmol/L),男性则为 600 ng/dL(21 nmol/L)。由这些数值可知,男性的睾酮水平平均比女性高约 20 倍。男性在接受 性腺切除术(去势或摘除睾丸)之后,睾酮水平与女性相似 (<50 ng/dL,合 1.7 nmol/L)(Nishiyama, 2014; Itty & Getzenberg, 2020)。
依据多项研究,对于患有多囊卵巢综合症(PCOS)的妇女,其睾酮水平平均值或中位数位于 41-75 ng/dL(150-275 pmol/L)之间,此时会出现由雄激素过剩引起的一系列显著临床症状(如面部/身体毛发过度生长)(Balen et al., 1995; Steinberger et al., 1998; Legro et al., 2010; Loh et al., 2020)。因此,即使是稍高于女性正常值的睾酮水平也会产生不良的雄激素效应。
需要注意,对激素水平的测定值会受到测定方法上的局限;由于化验准确性有别,不同测定方法、不同实验室所测出的激素水平差异显著(Shackleton, 2010; Stanczyk & Clarke, 2010; Deutsch, 2016; Carmina, Stanczyk, & Lobo, 2019)。目前,在准确性与可靠性上,基于质谱(MS)的测定方法(如液相色谱-质谱联用法,LC-MS),被认为优于放射免疫检定法(RIA)、酶联免疫吸附测定法(ELISA)等这些基于免疫测定法(IA)的方式(Stanczyk & Clarke, 2010; Carmina, Stanczyk, & Lobo, 2019)。因此,质谱测定法正逐渐成为性激素水平测定的实验室标准。
然而,即使都使用 LC-MS,不同实验室之间测定的激素水平也有差别——例如对 LC-MS 仪器的校准不同(Carmina, Stanczyk, & Lobo, 2019)。
对于顺性别妇女的睾酮水平,其准确范围可由 RIA 或 LC-MS 等测出为 20-50 ng/dL(0.69-1.7 nmol/L);但以 ELISA 等直接免疫测定法则会测得其正常上限为 70-80 ng/dL(2.4-2.8 nmol/L)(Carmina, Stanczyk, & Lobo, 2019)。当解读验血结果时,需要留意将其与同一实验室的参考范围进行比较(Deutsch, 2016)。
激素治疗概述
女性倾向跨性别者的激素治疗——又名女性化激素疗法 (FHT) 或(早年更为常见的)男跨女 (MtF) 激素替代疗法 (HRT) ——,旨在促进身体 女性化、 去男性化,并缓解 性别焦虑。用于实现这些变化的是 性激素类药物,包括 雌激素、孕激素,和 抗雄制剂 (AA);其可取代由性腺分泌的性激素,并将激素状况从男性典型转向女性典型。
女性化激素治疗的目的是使雌二醇和睾酮水平达到正常女性范围。文献中普遍推荐的雌二醇水平范围是 100-200 pg/mL(267-734 pmol/L),睾酮水平则要低于 50 ng/dL(1.7 nmol/L)(表格)。不过,高于 200 pg/mL 的雌二醇水平也有助于抑制睾酮水平。对于正处于青春期的女性倾向跨性别者,推荐维持稍低的雌二醇水平(不大于 50-60 pg/mL,或 180-220 pmol/L),因其更符合青春期特点。
血液中的性激素水平可以通过 血检 测量——其需要通过静脉采血,并送至实验室测定。这对女性倾向跨性别者很有用:其可确保激素状况已经按照治疗目标——即控制激素水平在女性范围——作出了合适的改变。
对性腺的抑制作用
在足够高的暴露量下,雌激素和雄激素能够完全抑制性腺性激素的分泌;而孕激素本身能够部分但大幅度抑制之。具体而言,根据一些有关顺性别男性与女性倾向跨性别者的研究的发现,雌二醇水平在 200 pg/mL(734 pmol/L)左右时一般能抑制睾酮水平约 90% (至大约 50 ng/dL,或 1.7 nmol/L);而雌二醇水平在 500 pg/mL(1,840 pmol/L)左右时,平均能抑制睾酮水平约 95% (至大约 20–30 ng/dL,或 0.7-1.0 nmol/L) (维基; 图表)。低于 200 pg/mL 的雌二醇水平也可抑制睾酮水平,不过程度有所降低 (Aly, 2019; Aly, 2019; Aly, 2020)。
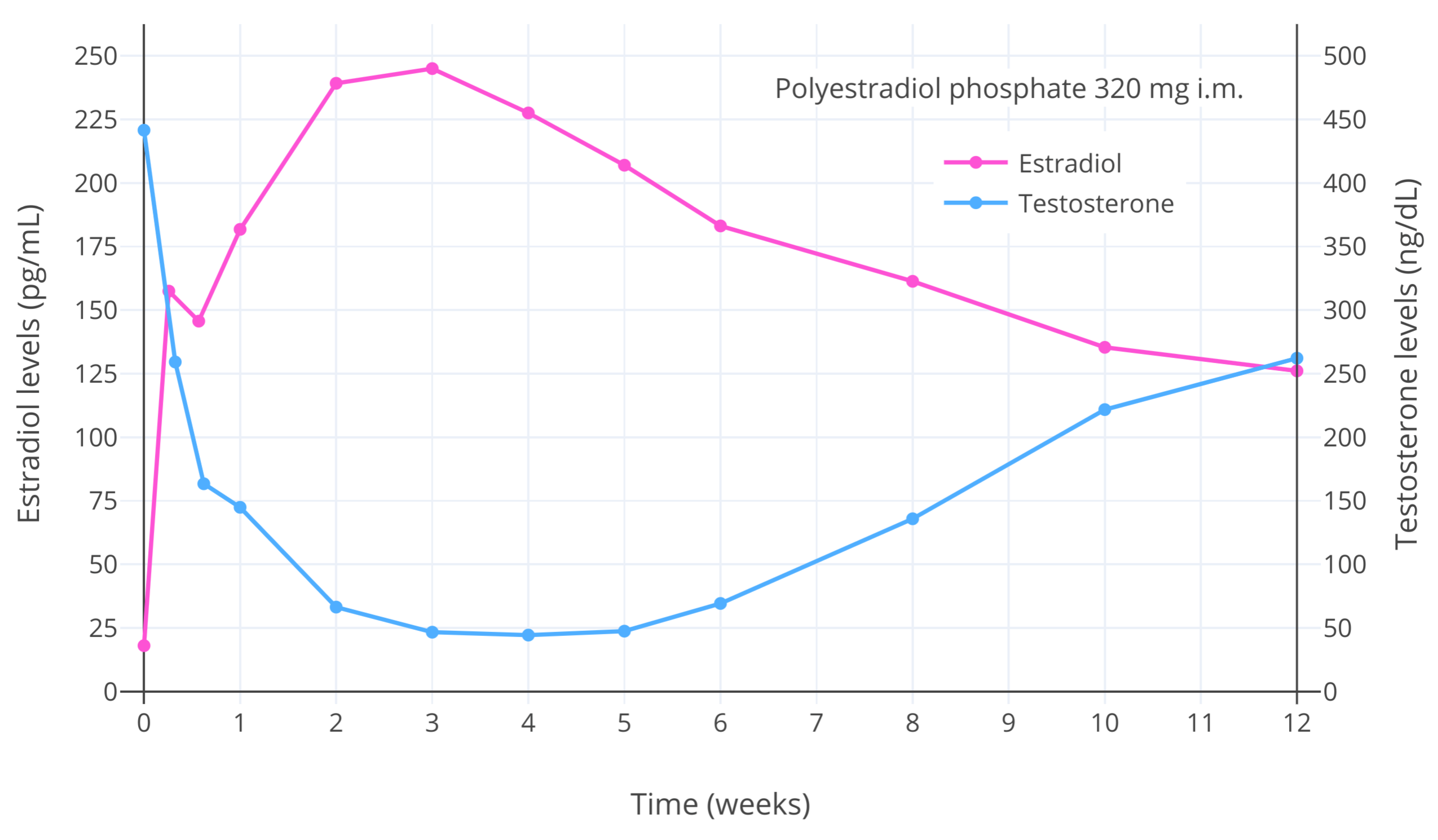
图 2:患有前列腺癌的男性在单次注射 320 毫克 聚磷酸雌二醇 (PEP) (一种长效雌二醇前体) 之后的雌二醇和睾酮水平变化 (Stege et al., 1996)。当雌二醇水平大于 200 pg/mL 时,睾酮水平最多可下降 90% (至大约 50 ng/dL,或 1.7 nmol/L)。本图显示了在受试人群当中,雌二醇浓度及其抑制性腺分泌睾酮、抑制血液睾酮水平的能力之间的关系。
单独使用孕激素最多可以抑制五至七成的睾酮水平 (至大约平均 150–300 ng/dL,或 5.2-10.4 nmol/L) (Aly, 2019; 维基)。然而,在与少量的雌激素合用时,孕激素的抗促性腺激素作用可以产生协同效应:最大有效剂量的孕激素对睾酮水平的抑制作用达到完全,抑制约 95% (至大约 20–30 ng/dL,或 0.7-1.0 nmol/L) (Aly, 2019)。因此,与单独使用雌激素或孕激素相比,合并使用时可以用较低的剂量将对睾酮的抑制作用最大化。
目前,女性倾向跨性别者已在利用雌激素和孕激素的抗促性腺激素作用,以抑制性腺睾酮的产生,并使睾酮水平更接近于顺性别妇女水平。应当指出,上述睾酮抑制率仅为平均值;在抑制睾酮方面,个人之间有很大差异。换句话说,有些人可能需要更多或更少的激素剂量来实现同样的睾酮水平降幅。
女性化效果发生的时间线
在男性和女性的正常青春期,性激素暴露量在几年内缓慢增加 (Aly, 2020),性成熟随之发生。对于不再处于青春期的跨性别者,其一般会立即使用相当于成年状态(乃至更高)的剂量的激素,这可能导致第二性征的变化发生得更快。
下表为女性倾向跨性别者激素治疗效果发生的时间表,在文献资料当中常被引用;此处转载之并略有改动 (表格)。其综合了口口相传的临床经验、专家意见和现有的有关女性倾向跨性别者激素治疗的临床研究之观点。由于当下与女性化激素疗法之效果相关的研究还很有限,故该表内容可能不大准确。
表 2:常见剂量的激素治疗在成年女性倾向跨性别者的效果 (表格):
| 效果 |
开始时间(1)
|
完成时间(1)
|
永久性 |
| 乳房发育 |
2–6 月 |
2–3 年 |
永久 |
| 毛发减少与生长减缓 |
3–12 月 |
>3 年(2)
|
可逆 |
| 脱发的减少与逆转 |
1–3 月 |
1–2 年 |
可逆 |
| 皮肤软化,出油与痤疮减少 |
3–6 月 |
未知 |
可逆 |
| 女性化脂肪再分布 |
3–6 月 |
2–5 年 |
可逆 |
| 肌肉重量与强度减少 |
3–6 月 |
1–2 年(3)
|
可逆 |
| 骨盆变宽和变圆(4)
|
未知 |
未知 |
永久 |
| 情绪、情感和行为的变化 |
立即发生 |
未知 |
可逆 |
| 性欲和自发性勃起减少 |
1–3 月 |
3–6 月 |
可逆 |
| 勃起功能障碍和射精量减少 |
1–3 月 |
不定 |
可逆 |
| 精子产量减少和不育 |
未知 |
>3 年 |
不定(5)
|
| 睾丸体积缩小 |
3–6 月 |
2–3 年 |
未知 |
| 声音变化 (例如,音调/共鸣下降) |
无(6)
|
N/A |
N/A |
| 身高变化 (如变矮) |
无(7)
|
N/A |
N/A |
(1) 由于遗传、饮食/营养、激素水平等因素,不同个体之间可能有很大差异。
(2) 激素治疗对女性倾向跨性别者的面部毛发密度的影响通常不大。彻底去除面部和身体毛发可以通过以下方法实现: 激光脱毛 和 电解脱毛。临时除毛可以使用 刮毛、拔毛、蜜蜡脱毛等方式。
(3) 可能因体育锻炼量的不同而有很大差异。
(4) 只发生在尚未完成生长板闭合的年轻人身上(在已结束青春期的人可能完全不会发生)。
(5) 只有雌激素,特别是大剂量的雌激素,似乎有可能导致长期或不可逆的不育;由抗雄激素引起的生育力受损通常在停药后容易恢复。
(6) 嗓音训练 是实现声音女性化的有效方式。
(7) 青少年人群的身高增长可能减小,但成年人不变。
资料来源如下(Gooren & Bunck (2004); Ingram & Thomas (2019); Hilton & Lundberg (2021))。
可在社交网站 Reddit 上的主题:https://reddit.com/r/TransBreastTimelines 查阅到女性化激素疗法引起的乳房发育与女性化的真实影像时间线。
有关激素类药物的详情
用于女性倾向跨性别者激素治疗的药物包括雌激素、孕激素和抗雄制剂。其中,雌激素产生女性化并抑制睾酮水平;而孕激素和抗雄制剂虽不会促进女性化,但可帮助进一步抑制/阻断睾酮。对睾酮的抑制会引起去男性化、并去除对雌激素促进的女性化效果之抑制作用。
雄激素有时候也以低剂量用于睾酮低的女性倾向跨性别者,不过其并非必要,其益处也不清楚。
上述激素类药物有许多不同类型、益处与风险。
雌激素、孕激素和抗雄制剂有不同的 剂型,并可通过不同的 给药途径 使用。给药途径可影响激素在体内的 吸收、分布、代谢和消除,在 生物利用度、血液和特定组织中的激素水平以及 代谢物 的模式等方面产生明显差异。这些差异会明显影响治疗效果。
表 3:女性倾向跨性别者激素治疗的主要给药途径:
| 途径 |
简称 |
描述 |
典型形式 |
| 口服给药 |
口服/ PO |
吞服 |
片剂、胶囊 |
| 舌下给药 |
舌下/ SL |
舌下含服并吸收 |
片剂 |
| 颊部给药 |
颊部/ BUC |
在脸颊或嘴唇下方放置并吸收 |
片剂 |
| 透皮给药 |
透皮/ TD |
涂抹在皮肤上并通过皮肤吸收 |
贴剂、凝胶、乳膏 |
| 直肠给药 |
直肠/ REC |
置入直肠并被直肠吸收 |
栓剂 |
| 肌肉注射 |
肌注/ IM |
注射到肌肉中(如臀部、大腿、手臂) |
溶液 (小瓶或安瓿瓶) |
| 皮下注射 |
皮注/ SC |
注射到皮下脂肪中 |
溶液 (小瓶或安瓿瓶) |
| 皮下植入 |
植入/ SCi |
通过手术切口植入皮下脂肪 |
微球 |
阴道给药 是顺性别女性使用激素类药物的主要途径之一。对于女性倾向跨性别者,虽然不可能通过原生阴道给药,但在接受阴道成形术之后可以通过新阴道给药。然而,新阴道的内壁并非原生的 阴道上皮 ,而通常是皮瓣或肠壁——这取决于手术的类型 (阴茎翻转术或乙状结肠移植术)。因此,如通过新阴道给药,其在性质上可能与透皮或直肠途径(取决于新阴道的类型)相似,而与原生阴道给药不同。不过需要指出,激素类药物在阴道及直肠途径上的特性被认为很相似(Goletiani, Keith, & Gorsky, 2007; 维基百科)。此外,根据一项研究,通过以 腹膜(腹部内膜;使用者较少)再造的新阴道吸收雌二醇的情况与顺性别妇女阴道给药的情况相似(Willemsen et al., 1985)。
因此,新阴道给药可作为部分女性倾向跨性别者的另一种给药选项(依情形而定)。不过,该途径尚需得到更充分的文献描述。
雌激素介绍
雌二醇是人体内主要的具有生物同质性的雌激素,也是女性化激素治疗主要使用的雌激素。雌二醇半水合物(EH)与雌二醇基本同质,并可与雌二醇互换。
雌二醇酯也时常作为雌二醇使用;其作为雌二醇的前体,在体内可转换为雌二醇,故其生物活性与雌二醇基本相同。不过,其作为注射剂使用时,从注射位点吸收的速率较慢,从而具有较长的作用时间;因此给药频率可以少些。主要使用的雌二醇酯包括:戊酸雌二醇 [EV; 品牌有“补佳乐”(Progynova)、Progynon Depot (俗称“富士日雌”——译者注)、Delestrogen] ,以及环戊丙酸雌二醇 (EC; 品牌有 Depo-Estradiol)。
聚磷酸雌二醇 (PEP; Estradurin) 是一种 聚合物 形式(即雌二醇分子链)的雌二醇前体注射剂;它的 代谢 缓慢,作用时间很长。
诸如 炔雌醇 (EE; 用于 避孕药)、合成雌激素 [CEEs; Premarin (倍美力); 用于 更年期激素治疗] 与 己烯雌酚 (DES; 已弃用) 等非生物同质性雌激素,因难以被肝脏代谢,故其对由雌激素调节的 肝脏合成 过程的影响与雌二醇等生物同质性激素相比不成比例 (Aly, 2020)。因此,其具有更大的血栓与心血管问题等健康风险。由于可能需要较高剂量雌激素来充分抑制睾酮水平,结合上述理由,最好不要将非生物同质性雌激素用于女性化激素治疗。
在性腺完整的女性倾向跨性别者当中,生理性水平下的雌二醇,通常不足以将其睾酮水平抑制到女性范围。因此,雌二醇通常会合并一种抗雄制剂或孕激素,用于女性化激素治疗。这使得雌二醇部分抑制睾酮水平的同时,剩余睾酮会被抗雄制剂、孕激素抑制或阻塞。不过,抗雄制剂或孕激素的加入也会增加药物的副作用、风险与开销。
作为替代,女性倾向跨性别者可单独使用高剂量——即超生理剂量——的雌二醇治疗;这样对睾酮的抑制作用会更强,并将睾酮水平抑制到女性范围。
在没有雄激素的情况下,雌激素的女性化作用在低剂量下也可达到最大。目前已知除了睾酮抑制作用更强之外,较高剂量雌激素并不会更好地促进女性化(Deutsch, 2016; Nolan & Cheung, 2021)。事实上,有迹象表明,如在治疗早期引入更高的雌激素剂量,则可能会导致乳房发育效果欠妥(本站未来将就此话题另行探讨)。因此,女性化激素治疗的临床目标更倾向于对睾酮的抑制,而非让雌二醇水平达到某个值。
更高剂量的雌激素(包括雌二醇)也有更大的不良健康影响的风险,如血栓和心血管问题 (Aly, 2020);因此,最好使用生理剂量的雌二醇。不过与此同时,大剂量雌激素会有利于抑制睾酮;而且非口服形式的雌二醇所带来的绝对风险很低——这对于有特定风险因素的人群尤为重要。这些风险因素包括:年龄大、缺乏运动、肥胖、孕激素的合并使用、吸烟、手术和罕见的血栓指标异常等。而对于没有相关风险因素的健康年轻人群,略微超生理剂量的非口服雌二醇应当足够安全(Aly, 2020)。
雌二醇的途径、剂量和水平
在女性化激素治疗当中,雌二醇与雌二醇酯通常以口服、舌下含服、透皮、注射(肌注或皮下注射)的形式使用(维基)。
口服雌二醇
口服雌二醇以雌二醇片剂的形式使用(维基百科; 图表)。另外,在部分国家(例如在许多东欧国家),会使用戊酸雌二醇(EV)片。此二者的唯一真正区别在于:同等质量下,EV 因多出一个戊酸基团,故雌二醇含量较少(约 76%),从而需要稍高的剂量(约 1.3 倍)以达到同等雌二醇水平(维基百科; 图表)。
口服雌二醇的作用时间较长,足可每日仅服一次。口服雌二醇不仅非常便利,开销也较少,从而成为女性倾向跨性别者最欢迎、最常用的雌二醇形式。
口服雌二醇的生物利用度较低(约 5%),在个体之间,同等剂量下所达到的雌二醇水平差异也很大。因此,某些女性倾向跨性别者使用口服雌二醇时,可能仅产生很低的雌二醇水平;对睾酮的抑制作用亦可能不充分(取决于抗雄制剂)。
口服雌二醇有一项重大缺点:因肝脏的首过效应,其在肝脏内引起的雌二醇水平畸高,从而对由雌激素调节的肝脏合成机制产生不相称的影响(Aly, 2020)。这还会增加血凝程度,增加血栓与心血管问题等一系列健康风险(Aly, 2020)。如换用适当剂量的非口服雌二醇,则上述健康隐患会大大减轻。因此,透皮等非口服形式的雌二醇更适合用于女性化激素治疗——尽管其便利性不及口服,开销也普遍更大。迄今已有建议提出,考虑到血栓与心血管问题的风险随年龄增长的缘故,所有 40 岁以上的女性倾向跨性别者应使用非口服途径(Aly, 2020)。
口服雌二醇并不适合女性倾向跨性别者用于高剂量单雌二醇疗法,因为(其难以达到)所需要的高雌二醇水平,其风险亦高于非口服途径;除了其对肝脏不相称的影响之外,其还会产生非生理水平的雌酮、硫酸雌酮等雌二醇代谢物。其临床意义(如有)尚未可知。
无论如何,根据现有研究,口服与非口服雌二醇已知在女性倾向跨性别者的乳房发育和女性化等方面具有同等效力(Sam, 2020; Aly, 2019)。
舌下含服雌二醇
口服雌二醇片剂可改为舌下含服。舌下含服雌二醇片剂有数倍于口服的生物利用度,从而可引起远高于口服的总雌二醇水平(Sam, 2021; 维基百科; 图表)。如需要的话,可以利用舌下含服雌二醇片剂,来减少剂量(同时减少开销)或者产生更高雌二醇水平以期更好地抑制睾酮。
不过,舌下含服雌二醇引起的雌二醇水平曲线比口服尖锐得多,维持较高雌二醇水平的时间也较短。因此,应该建议使用舌下含服雌二醇时要全天分多次服用,以保持较稳定的雌二醇水平。
目前在睾酮抑制作用与健康风险上,舌下含服雌二醇所引起的尖锐曲线对女性倾向跨性别者的临床意义尚未得到充分研究,因此基本不明。
与雌二醇类似,口服戊酸雌二醇片剂亦可用于舌下含服,且同样高效(Aly, 2019; 维基百科)。
舌下含服雌二醇的过程中可能会吞服部分成分,因此其事实上混合了舌下含服与口服的情形,从而具有一部分类似于口服雌二醇的健康风险(维基百科)。
面颊含服雌二醇应具有和舌下含服一致的特性,不过其相关研究更少,在女性倾向跨性别者当中的使用亦较少(维基百科)。
透皮雌二醇
透皮雌二醇包含贴片、凝胶、乳剂和喷雾剂等形式 (维基)。它们通常被贴在皮肤部位,如手臂、腹部和臀部。凝胶、乳剂与喷雾剂在使用后会很快变干,而贴片可在一段时间内持续附着于皮肤。由于皮肤的吸收速率有限,透皮雌二醇会像水库一样,在较长时间里持续释放雌二醇,从而维持非常稳定的雌二醇水平。因此,雌二醇凝胶、乳剂与喷剂皆适合每日一次使用;而贴片附着后可在 3-4 日或 7 日内(取决于品牌)持续释放雌二醇(表格)。
透皮雌二醇的开销要高于口服。凝胶、乳剂与喷剂的使用并不及口服方便;但贴片方便很多,因为其用药频率更低。然而,贴片有时会引起附着位点的不适,例如红肿、瘙痒等;而且偶尔会因吸附力不足而过早脱落。类似于口服,透皮雌二醇引起的雌二醇水平也在个体间差异显著;一些女性倾向跨性别者对其的吸收能力很差,雌二醇水平也很低、不足以抑制睾酮。
已知形如 Lenzetto 的雌二醇喷剂仅可达到很低的雌二醇水平,其在女性化激素治疗当中的疗效可能不足(Aly, 2020; 图表)。
透皮雌二醇因在健康风险上低于口服,而多为 40 岁以上的女性倾向跨性别者所使用。
对于高剂量雌二醇单服疗法,透皮雌二醇凝胶并不适合使用,因为其要达到可充分抑制睾酮的高雌二醇水平会很困难(Aly, 2019)。而另一方面,透皮雌二醇贴片可以用于该疗法:只需使用多个 100 μg/天的贴片(维基百科)。
不同皮肤部位对透皮雌二醇的吸收程度不同(维基百科)。如在生殖器部位(特别在阴囊或新阴唇)使用透皮雌二醇,其吸收率尤其高于常规皮肤位点,引起的雌二醇水平也远高于常规(Aly, 2019)。这一点很实用,其在需要时可用更少剂量(还有更少的药费)来达到更高的雌二醇水平、并更好地抑制睾酮。
透皮雌二醇不应用于乳房;因为这种方式已知不会更好促进乳房发育,而且其对健康的潜在影响(如对乳腺癌风险的影响)犹未可知。
注射用雌二醇
雌二醇注射剂可通过肌肉或皮下注射给药(维基; 维基; 图表)。雌二醇酯在注射之后,可贮存于注射位点并被缓慢吸收,从而具有较长作用时间;根据酯的类型,作用时间从数日到数月不等。目前普遍使用的注射用雌二醇酯包括:戊酸雌二醇(EV)、环戊丙酸雌二醇(EC)、庚酸雌二醇(EEn)与苯甲酸雌二醇(EB);其作用时间较短或适中。而更长效的雌二醇酯,如十一酸雌二醇(EU)与聚磷酸雌二醇(PEP),皆已不再生产及上市。
肌肉注射(简称肌注)常用的部位包括上臂三角肌、大腿的股外侧肌与股直肌、以及臀部侧肌。而皮下注射尽管不大常用,但在药代动力学特性上与肌注相似,而且比肌注更易于操作、痛感更少、也更便捷(维基)。然而,在确保安全与舒适的前提下,皮下注射的最大容积要小于肌注(根据部位不同,分别可达 1.5-3 毫升和 2-5 毫升)(Hopkins, & Arias, 2013; Usach et al., 2019)。
注射用雌二醇的开销普遍较小,但需要定期注射,因此相比其它途径显得不大方便;而且长期使用时会有在体内不断积累疤痕组织的风险。
注射用雌二醇已在全球许多地区(如在欧洲大部分地区)停售,故其可用地域有限。近年来,许多女性倾向跨性别者转而从黑市购买作坊自制的雌二醇注射剂使用。
雌二醇注射剂的剂量往往高于其它形式的雌二醇,并可产生极高的雌二醇水平。这有助于抑制睾酮,因此其似乎成为了最适合女性倾向跨性别者用于高剂量雌二醇单服疗法的选择。不过,如此高的剂量也很容易导致摄入过量,并提高不必要的风险(例如 Aly, 2020)。为引导女性倾向跨性别者选择合适的剂量与注射间隔,本站已有相关资料提供,包括对各注射剂引起的雌二醇水平的模拟器与非正式的荟萃分析(Aly, 2021; Aly, 2021);还有一份表格提供了各注射用雌二醇酯与其它雌二醇途径、形式之间大致等效的剂量数据(Aly, 2020)。
需要指出,遗憾的是,现有跨性别护理指南所推荐的注射用雌二醇酯剂量显然已高度过量、注射间隔也过长(例如每两周 10-40 mg 戊酸雌二醇),从而不宜用于治疗(Aly, 2021)。
笔者为高剂量雌二醇单服疗法所推荐的注射用雌二醇酯剂量与间隔,已于下方列出——其可维持平均雌二醇水平在 300 pg/mL(合 1,100 pmol/L)左右:
- 苯甲酸雌二醇——0.67 mg/日、1.33 mg/两日或 2 mg/三日(模拟曲线);
- 戊酸雌二醇——2 mg/三日、3.5 mg/五日或 5 mg/周(模拟曲线);
- 环戊丙酸雌二醇(油溶液)——5 mg/周、7 mg/十日或 10 mg/两周(模拟曲线);
- 环戊丙酸雌二醇(悬浮液)——2 mg/三日、3.5 mg/五日或 5 mg/周(模拟曲线);
- 庚酸雌二醇——5 mg/周、7 mg/十日或 10 mg/两周(模拟曲线);
- 十一酸雌二醇——10 mg/两周、20 mg/四周或 30 mg/六周(模拟曲线);
- 聚磷酸雌二醇——160 mg/月、240 mg/四十五天或 320 mg/两个月(模拟曲线)。
上述剂量与注射间隔应作为治疗的起点,且应根据验血结果按需调整;如果雌二醇水平过低、睾酮抑制不够充分,可适当增加剂量/缩小注射间隔;但如果雌二醇水平过高,在保持睾酮抑制作用充分的情况下,可适当减少剂量/扩大注射间隔。当合并使用抗雄制剂或孕激素时,应减少剂量,使雌二醇平均水平维持于 100-200 pg/mL(367-734 pmol/L)。类似地,接受性腺切除术之后,不再需要抑制睾酮了,此时应减少剂量。
雌二醇微球
雌二醇植入体是一种小球状的纯激素晶体,可由医师经外科手术植入皮下脂肪(维基百科)。其植入之后被缓慢吸收,每隔 4-6 个月需再次植入。由于需要进行小型手术,且开销较大、可用地域有限,故雌二醇植入体的使用不及其它途径那样普遍。还需指出,全球范围内几乎所有雌二醇植入体已不再生产上市,剩余的品种几乎仅以复合药剂的一部分存在。对其剂量进行调整的难度也高于其它雌二醇途径。
不过,尽管有种种实际限制,但雌二醇植入体可维持非常稳定的雌二醇水平,其超长作用时间也是在现有雌二醇形式当中最独特的便利之处。
补充说明
表 4:雌二醇的现有形式和推荐剂量(针对成年女性倾向跨性别者(1)):
| 药品 |
途径 |
形式 |
剂量 |
| 雌二醇 |
口服 |
片剂 |
2–8 mg/天 |
|
舌下或颊部含服 |
片剂 |
0.5–6 mg/天(2)
|
|
透皮 |
贴片 |
50–400 μg/天 |
|
透皮 |
凝胶 |
1.5–6 mg/天 |
|
透皮 |
喷剂 |
不推荐(3)
|
|
皮下植入 |
微球 |
25–150 mg/六个月 |
| 戊酸雌二醇 |
口服 |
片剂 |
3–10 mg/天(4)
|
|
舌下或颊部含服 |
片剂 |
1-8 mg/天(2)(4)
|
|
肌肉或皮下注射 |
油溶液 |
0.75-4 mg/五天;
或 1–6 mg/周;
或 1.5-9 mg/十天 |
| 环戊丙酸雌二醇 |
肌肉或皮下注射 |
油溶液 |
1–6 mg/周;
或 1.5–9 mg/十天;
或 2–12 mg/两周 |
|
肌肉或皮下注射 |
水悬浮液 |
0.75-4 mg/五天;
或 1–6 mg/周;
或 1.5-9 mg/十天 |
| 庚酸雌二醇 |
肌肉或皮下注射 |
油溶液 |
1–6 mg/周;
或 1.5–9 mg/十天;
或 2–12 mg/两周 |
| 苯甲酸雌二醇 |
肌肉或皮下注射 |
油溶液 |
0.15-0.75 mg/天;
或 0.3-1.5 mg/两天;
或 0.45-2.25 mg/三天 |
| 十一酸雌二醇 |
肌肉或皮下注射 |
油溶液 |
2-12 mg/两周;
或 4-24 mg/四周;
或 6-36 mg/六周 |
| 聚磷酸雌二醇 |
肌肉注射 |
水溶液 |
40–160 mg/月(5)
|
(1) 处于青春期的女性倾向跨性别者应使用更低剂量雌二醇,以模拟女性正常青春期之间的雌二醇暴露量(Aly, 2020)。
(2) 建议每日分 2-4 次(即每隔 6-12 小时)分量含服,而非每日一次(Sam, 2021)。
(3) 喷剂形式在通常剂量下仅可产生非常低的雌二醇水平,并不适合用于女性化激素治疗(Aly, 2020; 图表)。
(4) 戊酸雌二醇的雌二醇含量约为 75%,故其剂量需增至约 1.3 倍,以达到同等雌二醇水平(Aly, 2019; Sam, 2021)。
(5) 可于最初 1-2 次注射中使用稍高的起始负荷剂量(如 240-320 mg),以使雌二醇水平更快达到稳态;不过,聚磷酸雌二醇近来已不再生产,显然也不再能获取。
另可于他处查阅不同形式、途径与剂量的雌二醇所产生的雌二醇水平(维基百科; 表格),以及其大致等效的剂量数据(Aly, 2020)。
在雌二醇治疗过程中,个体之间达到的雌二醇水平有很大差异。也就是说,使用相同剂量的雌二醇治疗时,个体之间的雌二醇水平可能差别很大。这种差异性在口服和透皮途径中最明显,但即使是雌二醇注射剂及其它形式,也会产生一定差异。因此,雌二醇剂量的推荐值并非放之四海而皆准;应以验血结果为指引,根据每个人的情况实现“一人一方”。
还应注意的是,某些特定途径所产生的雌二醇水平波动很大,从而使得其每次测定的结果差别会很明显。这里要特别提到舌下含服和注射用雌二醇:其在雌二醇水平上的波动是可预见的,在解读验血结果时也必须清楚这一点。验血结果上的差异可通过选择有人指导的、一致的时机进行采血而降至最小。
女性倾向跨性别者在切除性腺后,便不再需要抑制睾酮了;因此,如此前使用较高或超生理剂量的雌二醇,可适当降低之,使其接近于顺性别妇女的正常生理水平。
孕激素介绍
孕激素包含天然孕酮和合成孕酮制剂。其中,合成孕酮是人工合成的孕激素,由孕酮或睾酮分子修饰 而来;其种类繁多,依其结构类型而产生不同特性(表格)。这些结构类型及其主要成员包括:
- 17α-羟孕酮衍生物,如醋酸甲羟孕酮[MPA; 品牌有 Provera (安宫黄体酮)、Depo-Provera (得普乐)];
- 19-去甲睾酮衍生物,如炔诺酮 (NET; 品牌较多);
- 去氢孕酮衍生物,如地屈孕酮[Duphaston (达芙通)];
- 17α-螺内酯衍生物,如屈螺酮[Slynd, Yasmin (优思明)]。
合成孕酮的开发得益于其作为药物使用时在体内的性状比孕酮更佳。当下仅有少数临床使用的孕激素被用于女性化激素治疗;不过,大多数孕激素都有相同的孕激素作用(少部分除外),因此理论上几乎任何孕激素皆可一用。
孕激素通过其孕激素效力与对脑垂体分泌促性腺激素的抑制作用(与剂量相关),实现抗促性腺激素作用;这使得促性腺激素对性腺的刺激作用减弱,从而减少性激素分泌量、降低生育能力。迄今已有多项研究描述了不同孕激素在顺性别男性、女性倾向跨性别者身上产生的与剂量相关的睾酮抑制作用(Nieschlag, Zitzmann, & Kamischke, 2003; Nieschlag, 2010; Nieschlag & Behre, 2012; Zitzmann et al., 2017; Aly, 2019)。上述研究的对象包括:
仅使用高剂量孕激素时,其对睾酮水平的平均抑制率最大可达 50-70% 左右(Aly, 2019; Zitzmann et al., 2017 (图表));而当合并雌激素使用时,抑制率提升至约 95%,此时睾酮水平落入到女性正常范围(Aly, 2019)。在顺性别妇女当中,孕激素似乎往往能以相当于抑制排卵所需的约 5-10 倍的剂量,最大限度地发挥睾酮抑制能力(Aly, 2019)。
在诸多孕激素当中,口服孕酮与地诺孕素属于例外:因为其效力较弱、性状也不寻常,对促性腺激素的拮抗效应不高,无法很好地抑制睾酮水平(Aly, 2018; 维基百科; 维基百科)。
对于女性倾向跨性别者,孕激素除了增强对睾酮的抑制作用之外,在女性化及乳房发育等方面并无任何明显或已知的助益。尽管有女性倾向跨性别者传言,其使用孕激素后促进了乳房发育;但孕激素在乳房尺寸或形状上有多少促进作用的问题尚存在争议,目前也尚无任何理论或证据支持之(维基百科; Aly, 2020; Aly, 2020)。过早地引入孕激素有可能会对乳房发育产生负面影响(尤其在高剂量下)(Aly, 2019)。
此外,有女性倾向跨性别者也传言,孕激素对其性欲有促进作用;不过,笔者在一篇文献评述里指出,无论孕酮还是合成孕酮皆不会增加人的性欲(Aly, 2020)。相反,现有证据表明孕激素对性欲无影响或起负面作用——其中负面作用或仅在高剂量下产生(Aly, 2020)。
还有人声称,孕酮也会改善女性倾向跨性别者的情绪;但目前此观点也尚未得到临床证据支持(Coleman et al., 2022; Nolan et al., 2022)。需要指出,有约 30% 的顺性别妇女进入黄体期后,由于高孕酮水平所带来的代谢产物:神经甾体(如别孕烷醇酮)的作用,其情绪事实上反而会变差;更有约 2-10% 的妇女会因其产生明显不良反应(Bäckström et al., 2011; Edler Schiller, Schmidt, & Rubinow, 2014; Sundström-Poromaa et al., 2020)。
尚需更多研究来评估孕激素对女性倾向跨性别者的可能益处。
大多数临床应用的孕激素有 脱靶效应(除孕激素活性之外);这些效应可能有益,也可能有害,取决于其在哪方面起作用(Kuhl, 2005; Stanczyk et al., 2013; 维基; 表格)。
对于孕酮,其具有神经甾体等各种其它效应,可对神经中枢系统产生影响——合成孕酮并不具备此特性。
对于 MPA、NET 及其衍生物,其具有较弱雄激素效力——这在女性化激素治疗中是不利的。
对于 NET 和某些类似的合成孕酮,其在高剂量下会产生炔雌醇(EE)等代谢物,从而产生类似于 EE 的雌激素作用——包括血栓和心血管问题的风险。
孕激素的其它脱靶效应包括抗雄激素、糖皮质激素与抗盐皮质激素效力。这些作用具有不同的治疗效果(如抑制或阻断雄激素)、副作用和健康风险。
值得一提的是,一些合成孕酮并不产生任何有害脱靶效应(即雄激素或糖皮质激素效力);包括 CPA(低剂量下)、屈螺酮(DRSP)、地诺孕素、醋酸诺美孕酮(NOMAC)、地屈孕酮和己酸羟孕酮(OHPC)等。
在雌激素疗法中加入孕激素,会带来许多不良健康影响,其中包括血栓(维基百科; Aly, 2020)、冠心病(维基百科)与乳腺癌(维基; Aly, 2020)等风险。高剂量孕激素也与某些良性脑瘤的风险增加有关,包括脑膜瘤和泌乳素瘤(维基; Aly, 2020)。
冠心病风险可能是由于由某些孕激素的较弱雄激素效力引起的血脂改变;至于上文提及的其它风险,则可能是由其孕激素活性引起的(Stanczyk et al., 2013; Jiang & Tian, 2017)。
除了健康风险外,孕激素还与不良情绪变化有关;不过,此影响尚存在争议,至今无任何有力证据支持(维基; 维基)。
除去上述影响后,则孕激素多具有较好耐受性,副作用也极少。
与合成孕酮不同,天然孕酮无任何不利的脱靶效应;其不具备雄激素效力,不会对血脂有任何不良影响,从而被认为不会增加冠心病风险。在雌激素疗法当中加入口服孕酮,并不会增加血栓风险(维基)。
此外,相较于合成孕酮,口服孕酮在短期治疗中有更低的乳腺癌风险;但需要指出,在长期暴露的情况下风险也不低(维基; Aly, 2020)。因此,有学者认为,出于尚未完全阐明的原因,孕酮可能比合成孕酮更为安全;并且其应作为顺性别妇女、女性倾向跨性别者的激素治疗当中首选的孕激素。
然而,已有一些理论观点反驳之。例如,通常剂量下的口服孕酮已知仅可产生很低的孕酮水平,孕激素效力也较弱;口服孕酮看似更好的安全性,可能只是由其较低的孕酮水平及孕激素作用剂量所产生的一种假象(Aly, 2018; 维基)。
对于足以产生生理、完全孕激素效力的剂量下的非口服形式孕酮,其健康影响迄今尚未被准确评估;其风险应与合成孕酮相同(Aly, 2018; 维基)。
由于孕激素对女性化和乳房发育没有确切影响,以及其不良效应和风险,目前其在女性化激素治疗中并不常用。然而,有一个重要的例外,那就是醋酸环丙孕酮(CPA);其作为抗雄制剂,已广泛用于女性化激素治疗,以抑制睾酮分泌,同时在女性倾向跨性别者通常使用的剂量下也是一种强效孕激素。CPA 将会在下文“抗雄制剂”一章加以讨论。
虽然孕激素有种种健康风险,但顺性别妇女体内也有孕酮,而其绝对风险在健康的年轻人中非常低。像乳腺癌这样的风险也需要很多年才能形成。而且,孕激素对睾酮的抑制作用对于女性倾向跨性别者应大有裨益;CPA 也因为这点而被广泛使用。对女性倾向跨性别者来说,将孕激素治疗时长控制到一定范围(例如在几年内用以抑制睾酮水平,直至切除性腺),应该会很合适。
孕酮与合成孕酮的途径、剂量和水平
女性倾向跨性别者可通过口服、舌下含服、直肠、肌肉/皮下注射等途径使用孕酮(维基);而合成孕酮通常用于口服,不过其中某些也以注射剂的形式提供(维基)。
口服孕酮
孕酮最常用的途径是口服。口服所用的是一种充满油的胶囊,内含 100 或 200 mg 的微粉化孕酮;其品牌包括 Prometrium、Utrogestan 与 Microgest,使用广泛。不过,其引起的孕酮水平已知非常低(100 mg/天剂量下仅有 <2 ng/mL,或 <6.4 nmol/L;以目前先进的测定法 LC-MS 检测),不足以在各方面产生合适的孕激素效力(Aly, 2018; 维基)。相应地,在顺性别男性当中,即使使用高剂量孕酮(400 mg/天)亦未显现其抗促性腺激素效力、或对睾酮的抑制作用(Aly, 2018; 维基)。这与非口服途径的孕酮、以及合成孕酮形成鲜明对比——它们皆可实实在在地产生与剂量相关的睾酮抑制作用(Aly, 2019; 维基)。
除较低孕激素效力以外,口服孕酮还会被过多地代谢成为别孕烷醇酮、孕烷醇酮等神经甾体;这些代谢物作为强效的 γ-氨基丁酸 A 型(GABA-A)受体异构激动剂,会产生类似于酒精的不良副作用——包括镇静,认知、记忆与运动障碍,以及情绪变化等(维基; 维基)。
因此,非口服途径虽有所不便,但却是远优于口服的选项。
舌下含服孕酮
目前,孕酮的舌下含服片剂尚有存世,其以 Luteina 的品牌名上市;但仅于波兰和乌克兰有售(维基)。
口服孕酮理论上亦可用于舌下含服,与口服雌二醇类似;然而,要含服口服孕酮胶囊里面的油,会很有难度,也不大舒适。
颊部含服的孕酮具有和舌下含服相似的特性,早年曾有相关药物,但如今已不再上市(维基)。
直肠给药的孕酮
孕酮可以栓剂的形式用于直肠给药;其品牌有 Cyclogest(维基)。不过,直肠栓剂仅在英国等少数国家上市(维基)。
口服孕酮胶囊亦可用于直肠给药(尽管未被正式批准),这样可使得孕酮水平远高于口服(Aly, 2018)。相比于口服,直肠给药可轻松达到和(妇女)正常黄体期相当的孕酮水平(维基; Aly, 2018)。
直肠给药尽管有所不便,但应是最适合女性倾向跨性别者的孕酮给药途径。
注射用孕酮
注射用孕酮有以下形式:油溶液(用于肌注;品牌有 Proluton、Progestaject 与 Gestone 等)(维基)和水溶液(用于皮下注射;品牌有 Prolutex)(维基)等。其中孕酮油溶液注射剂在全球范围广泛上市,而水溶液注射剂仅在部分欧洲国家可用(维基)。
注射用孕酮(无论何种途径)的作用时间相对较短,每 1-3 天就须注射一次(维基; 维基);这对大多数人而言过于不便。不同于雌二醇,由于孕酮本身并无任何可供结合为酯的羟基团,故其无法合成孕酮酯——其本应在注射后具有更长的作用时间(维基)。
注射用孕酮微晶水悬浮液曾在早年上市一段时间,其具有 1-2 周的作用时间;但因其在注射位点会引起疼痛,故最终停止了生产(Aly, 2019; 维基)。
其它给药途径的孕酮
诸如透皮孕酮与皮下植入用的孕酮微球等途径也有存世,但未被大规模生产,医学上也鲜少使用(维基)。这是因为这些途径的孕酮效力较低、很难达到治疗所需的孕酮水平(维基; 维基)。此外,孕酮微球往往会有相当一部分被挤压出去(维基)。
不过,某些配药房会制作此类途径的孕酮。
口服与注射用合成孕酮
绝大多数合成孕酮制剂以固体片剂的形式供口服(维基)。不同于孕酮,这些人工合成物对肝肠的代谢作用有较强抗性,故其口服的生物利用度较高;不仅如此,其几乎——或者完全——不会在肝脏内的孕酮受体表达,也没有任何已知的由孕激素活性对肝脏合成机制产生影响的首过效应(这点与雌激素受体不同)(Lax, 1987; Stanczyk, Mathews, & Cortessis, 2017)。因此,口服途径的合成孕酮仅表达孕激素活性,没有任何明显疑点。
不过,有的合成孕酮会产生脱靶效应,例如雄激素/雌激素/抗糖皮质激素活性;其会引起非预期的脂质改变与促凝作用(procoagulation)等不良反应——其有可能经口服之后的首过效应而加强。
有一批合成孕酮以注射剂(用于肌注或皮下注射)的形式提供。这些合成孕酮包括:醋酸甲羟孕酮(MPA)、庚酸炔诺酮(NETE)、己酸羟孕酮(OHPC)与苯乙酮缩二羟孕酮(DHPA)等。除单独使用外,合成孕酮还以注射用复方避孕药的形式与雌二醇酯合用。这些注射剂多被拉丁美洲的女性倾向跨性别者用于激素治疗。
与孕酮仅有数日的作用时间不同,注射用合成孕酮的作用时间可达数周至数月不等;其注射间隔也远大于孕酮。
补充说明
表 5:可用于女性倾向跨性别者的孕激素形式和推荐剂量:
| 药品 |
途径 |
形式 |
剂量 |
| 孕酮 |
口服 |
充油胶囊 |
100–300 mg 1–2次/天 |
|
直肠给药 |
栓剂; 油剂胶囊 |
100–200 mg 1–2次/天 |
|
肌肉注射 |
油剂溶液 |
25–75 mg/1–3 天 |
|
皮下注射 |
水溶液 |
25 mg/天 |
| 合成孕酮 |
口服; 肌肉或皮下注射 |
片剂; 油溶液; 水溶液 |
不定 |
另可于他处的表格与图表查阅不同形式、途径和剂量的孕酮所引起的孕酮水平 (对于口服孕酮仅含 LC-MS 或经层析分离的免疫测定法的结果) 。
与雌二醇一样,孕酮水平在个体间有很大差异。相反,合成孕酮在个体之间产生的差异相对较小。
在切除性腺后,可将孕激素的剂量降低,或调整至接近于女性的正常生理暴露量;亦可完全停用之。
抗雄激素制剂介绍
除了雌激素和孕激素外,还有一类用于女性化激素治疗的激素类药物,即抗雄激素制剂 (AA)。这些药物可通过减少雄激素合成、降低雄激素水平,或通过直接阻断雄激素活动,来减少体内雄激素的效力。其作用机制各异,可分为雄激素受体(AR)拮抗剂、抗促性腺激素制剂与雄激素合成抑制剂。
AR 拮抗剂可直接阻断睾酮、双氢睾酮(DHT)等雄激素的作用。它们与 AR 结合而不激活,从而阻止雄激素与受体结合。由于其作为雄激素的竞争性阻断剂的机制,其抗雄效力与剂量及睾酮水平高度相关。其并不通过降低睾酮水平来发挥作用——尽管其中某些会有额外的抗雄激素活性、从而使睾酮水平降低。因此,与可降低睾酮水平的抗雄制剂不同,当使用它们时,血检的参考价值可能不大。
AR 拮抗剂种类包括甾体类抗雄制剂 (SAA),如螺内酯 (Aldactone)和醋酸环丙孕酮 (CPA; Androcur (俗称“色谱龙”——译者注));以及非甾体类抗雄制剂 (NSAA),如比卡鲁胺 (Casodex)。
抗促性腺激素制剂可通过抑制脑垂体中 GnRH 介导的促性腺激素的分泌,来抑制雄激素的性腺分泌。它们包括雌激素和孕激素。此外,GnRH 激动剂(如亮丙瑞林 (Lupron))和 GnRH 拮抗剂(如恶拉戈利 (Orilissa))的作用与此类似,亦可视为抗促性腺激素制剂。
雄激素合成抑制剂可抑制雄激素的酶介导的合成。它们包括 5α-还原酶抑制剂 (5α-RI),如非那雄胺 (“保法止”,Propecia) 和度他雄胺 (“适尿通”,Avodart);以及 17α-羟化酶/17,20-还原酶抑制剂,如 酮康唑 (“仁山利舒”,Nizoral) 和醋酸阿比特龙 (Zytiga)。然而,这些药物有其局限性 (如毒性、高成本、未经大量测试等),因而不被用于女性化激素治疗。
尽管抗促性腺激素制剂和雄激素合成抑制剂具有继发于雄激素水平下降的抗雄激素作用,但它们通常不被称为“抗雄制剂”;相反,这一称呼基本仅用于 AR 拮抗剂。不过这并不妨碍它们也归到抗雄制剂一列。
抗雄制剂可以在性腺切除后停用。但如果出现了痤疮、脂溢性皮炎和脱发等与雄激素相关的症状,则可继续以低剂量 AR 拮抗剂(如 100-200 mg/天的螺内酯,或 12.5-25 mg/天的比卡鲁胺)进行治疗。
表 6:可为女性倾向跨性别者所用的抗雄激素之形式和推荐剂量:
| 药品 |
类型 |
途径 |
形式 |
剂量 |
| 螺内酯 |
AR 拮抗剂; 弱雄激素合成抑制剂 |
口服 |
片剂 |
100–400 mg/天(1)(2)
|
| 比卡鲁胺 |
AR 拮抗剂 |
口服 |
片剂 |
12.5–50 mg/天(1)
|
| 醋酸环丙孕酮 |
孕激素; AR 拮抗剂 |
口服 |
片剂 |
2.5–12.5 mg/天(3)
|
(1) 螺内酯与比卡鲁胺的剂量是基于睾酮水平已大幅抑制(≤200 ng/dL,或 <6.9 nmol/L)的前提下而定;如睾酮水平仍大于该范围,则需更大剂量。
(2) 螺内酯及其代谢物的半衰期相对较短,建议每日分两次分量服用(如每日两次 100-200 mg)。
(3) 具体而言,CPA 的剂量范围相当于服四分之一到一片 10 mg 片剂的量(2.5–10 mg/天);或者每 1-3 日服四分之一片 50 mg 片剂的量(4.2-12.5 mg/天)。其中,5-12.5 mg/天的剂量可确保睾酮抑制效力达到最大;更低剂量下的效力应稍弱(Aly, 2019)。
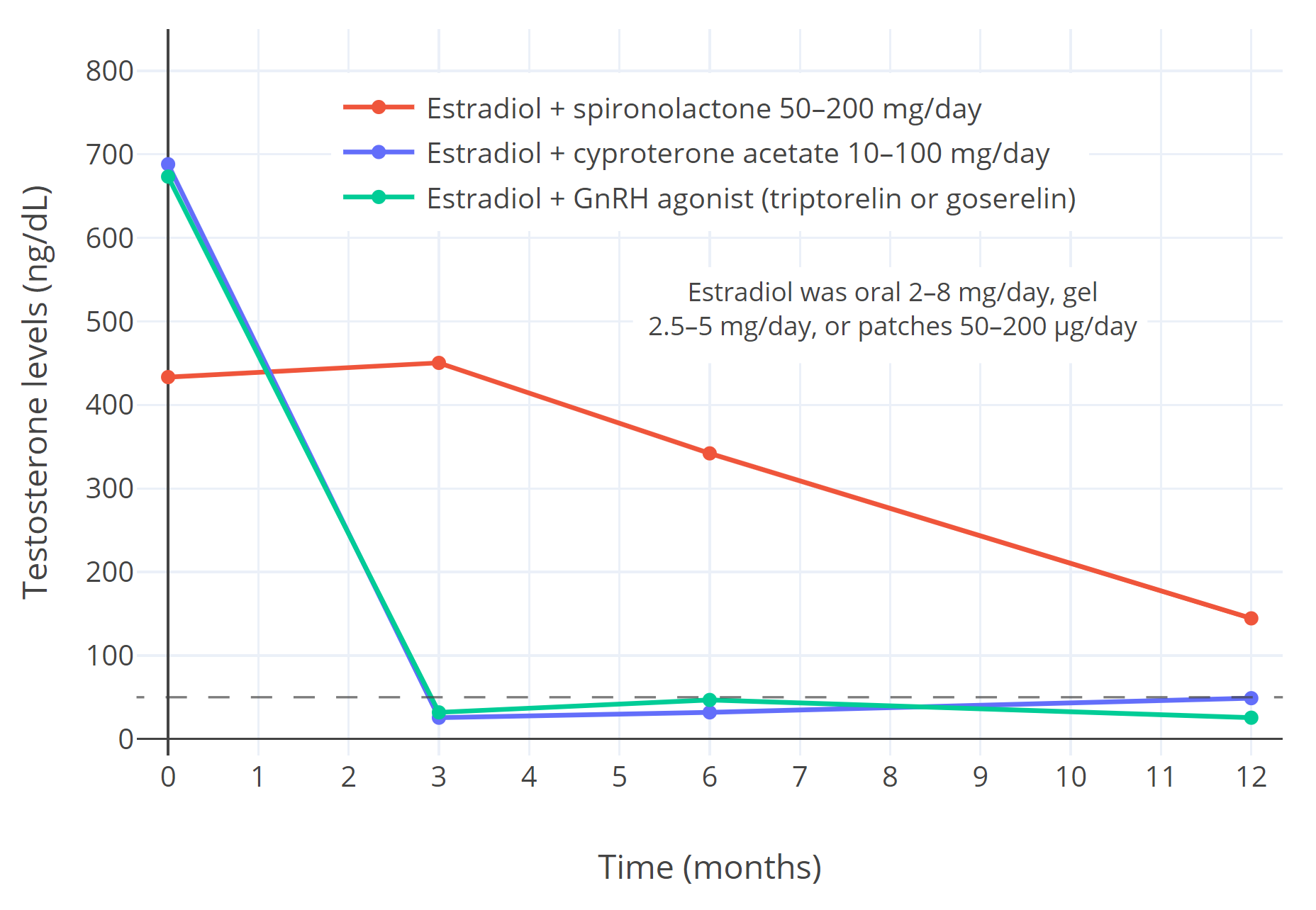
图 3:在女性倾向跨性别者一年的激素治疗中,使用雌二醇合并不同抗雄制剂时对性腺分泌睾酮的抑制以及血清睾酮水平(Sofer et al., 2020, PDF 文档)。其中,所用雌二醇包括 2-8 mg/天的口服片剂、2.5-5 mg/天的透皮凝胶与 50-200 μg/天的透皮贴片;所用抗雄制剂包括 50-200 mg/天的螺内酯(16 人)、醋酸环丙孕酮(41 人)与 GnRH 激动剂(10 人;具体为每月注射 3.75 mg 的曲普瑞林、或 3.6 mg 的戈舍瑞林)(Sofer et al., 2020)。
应当指出,低剂量 CPA(10-12.5 mg/天)的睾酮抑制作用与高剂量(25-100 mg/天)一致,因此不应再使用高剂量(Aly, 2019)。
横向虚线代表女性体内睾酮水平正常范围的上限。
醋酸环丙孕酮
醋酸环丙孕酮 (CPA; Androcur) 是一种孕激素与抗雄制剂。在顺性别妇女当中,其作为孕激素广泛用于激素避孕、围绝经期激素疗法等。CPA 还作为抗雄制剂用于顺性别妇女、男性改善对雄激素敏感的状况:其可治疗顺性别妇女的痤疮、多毛症(脸部/身体毛发生长过多)、脱发、由多囊卵巢综合征(PCOS)引起的高雄激素血症等症状;而对于顺性别男性,其可治疗前列腺癌,降低性冲动以控制性欲倒错、性欲过盛、性侵犯等性健康问题。
除顺性别人群之外,CPA 还作为抗雄制剂,广泛用于女性倾向跨性别者的激素治疗。在美国 CPA 尚未上市,故使用最多的是螺内酯;不过在美国以外,CPA 的覆盖范围很广;其在欧洲(也许还包括全球范围内)成了女性倾向跨性别者使用最多的抗雄制剂(T’Sjoen et al., 2019; Glintborg et al., 2021; Coleman et al., 2022)。
CPA 作为抗雄制剂,在抑制睾酮上有孕激素活性(也起到抗促性腺激素活性)与 AR 拮抗效应等两重机制;不过,CPA 的孕激素效力远高于其 AR 拮抗效力(Aly, 2019)。
当 CPA 作为孕激素用于顺性别妇女时,其剂量约为 2 mg/天;这可产生与黄体期孕酮的生理水平相当的孕激素效力,用途包括抑制促性腺激素的分泌、抑制排卵、转化并保护子宫内膜等(Aly, 2019)。而与此相反,用于改善雄激素相关状况的通常剂量多达 50-300 mg/天;如此高的剂量会导致孕激素摄入高度过量,相关副作用与风险也会变大(Aly, 2019)。
在早年,为女性倾向跨性别者所用的 CPA 剂量为 50-150 mg/天(Aly, 2019);然而,近年来 CPA 剂量已大幅下降,如今已有建议指出其剂量不应高于 10-12.5 mg/天(Aly, 2019; Coleman et al., 2022—WPATH SOC8)。如此低的 CPA 剂量仍可产生较强孕激素效力,当结合雌二醇使用时,其对睾酮的抑制率与高剂量下相当(Aly, 2019; Meyer et al., 2020; Even Zohar et al., 2021; Kuijpers et al., 2021; Coleman et al., 2022)。甚至以更低的剂量(如 5-6.25 mg/天)也依旧会(在这方面)保持完全效力(Aly, 2019)。
当单独服用时,CPA 在受试者中对睾酮的抑制率通常约可达 50-70%,睾酮水平降至约 150-300 ng/dL(合 5.2-10.4 nmol/L)(Meriggiola et al., 2002; Toorians et al., 2003; Giltay et al., 2004; T’Sjoen et al., 2005; Tack et al., 2017; Zitzmann et al., 2017; Aly, 2019)。而单服低剂量 CPA(如 10 mg/天)的睾酮抑制率与单服高剂量(如 50-100 mg/天)的相当;这表明,在相对较低的临床剂量下,CPA 已可完全发挥抗促性腺激素效力(Aly, 2019)。此剂量已经是顺性别妇女用以抑制排卵的剂量的 5-10 倍——这种与剂量有关的反应在其它孕激素上也同样观测得到(Aly, 2019)。
根据上文,无论何种剂量下,单服 CPA 皆无法将睾酮水平抑制到女性正常范围(<50 ng/dL, 或 1.7 nmol/L);但当与雌二醇合并使用时,即使雌二醇剂量很低,也可稳定抑制睾酮到女性范围内(Aly, 2019; Angus et al., 2019; Gava et al., 2020; Sofer et al., 2020; Collet et al., 2022)。不过,这似乎需要雌二醇水平达到某个最小值(平均应在 60 pg/mL,或 220 pmol/L 左右)来实现;如果女性倾向跨性别者使用 CPA 时合并的雌二醇剂量过小,从而使其雌二醇水平偶尔低于上述阈值,那么其睾酮抑制效力有可能达不到完全(Aly, 2019)。
除睾酮抑制作用之外,CPA 还可阻断雄激素受体(依剂量而定)(Aly, 2019)。不过,要达到明显的 AR 拮抗效应,还需要很高的剂量(如 50-300 mg/天);而较低剂量(如 ≤12.5 mg/天)可能无法产生任何有意义的拮抗作用(Aly, 2019)。因此,低剂量 CPA 可认为基本仅有孕激素效力,而其 AR 拮抗效力极低以至不显现。从这方面而言,将低剂量 CPA 归为“抗雄制剂”——而非“孕激素”——可能会被认为名不副实。
至于高剂量 CPA(>12.5 mg/天),因其会造成孕激素摄入高度过量,而被认为不再安全,因此女性倾向跨性别者不应再使用之。而且,当合用雌二醇与 CPA 时通常已可将睾酮水平抑制到女性正常范围,因此女性倾向跨性别者实际上并不需要其阻断 AR 的能力(Aly, 2019)。
CPA 已知会产生多种副作用;其中包括:
CPA 的副作用被认为与剂量相关;为将副作用降至最小,应尽量使用最小有效剂量。
CPA 作为孕激素时,与如下风险有关(即便以极低剂量,如 2 mg/天):
而高剂量 CPA 不仅被相信亦有上述风险,而且会引起:
-
高泌乳素水平(Sofer et al., 2020; Wilson et al., 2020; 维基);
- 特定的、通常良性的脑瘤,包括:
-
泌乳素瘤(McFarlane, Zajac, & Cheung, 2018; Nota et al., 2018; 维基);
-
脑膜瘤(McFarlane, Zajac, & Cheung, 2018; Nota et al., 2018; Millward et al., 2021; Weill et al., 2021; Aly, 2020; 维基)。
上述风险应该与剂量相关,可通过更少的剂量而控制到最小。
- 除孕激素活性以外,还在肝脏内表达很弱、但明显的雄激素效力,从而会对血脂产生不利影响——例如:
- 以不明机理引起的其它潜在不良反应,包括:高血压与胰岛素抗性增强(Martinez-Martin et al., 2022);
- 肝功能指标异常(转氨酶水平升高)与罕见的肝中毒(在女性倾向跨性别者所用 25-50 mg/天的剂量下)(Heinemann et al., 1997; Bessone et al., 2016; Kumar et al., 2021; 维基百科; 表格)。
如剂量低于 20 mg/天,则肝功能异常与肝中毒的可能性大幅下降(维基百科)。
迄今已有一百多例由 CPA 引起的明显肝中毒病例报告,但其中仅有两例使用 50 mg/天或以下的剂量(维基百科; 表格)。
如以 CPA 进行治疗,建议应监测泌乳素水平与肝功能,以分别检测泌乳素瘤与肝中毒;同时,如剂量超过 10 mg/天,还建议定期进行核磁共振(MRI)扫描以监测脑膜瘤(Aly, 2020)。
CPA 通常以 10、50、100 mg 片剂的形式供口服(维基百科)。其也有 300 mg 长效注射剂的形式,在部分国家以 Androcur Depot 的品牌上市(维基百科)。不过后者在女性倾向跨性别者当中并不常用,其也会产生极高的 CPA 暴露量。
为使用更低剂量,可用切药器切分 CPA 片剂(如通过 50 mg 片剂实现 12.5 mg 剂量)。
CPA 具有较长的消除半衰期,约达 1.6-4.3 天(维基百科; Aly, 2019)。因此,其可每日一服,需要时还可隔日或每三日一服,来使剂量更小(Aly, 2019)。
如上文所述,CPA 是在正为女性倾向跨性别者所用的较低剂量(如 5-12.5 mg/天)之下也很强力的孕激素。因此,服用 CPA 时无需再加入另一种孕激素(如孕酮),也没有意义——至少如果需要的是孕激素效力的话。服用 CPA 的人常忽视这一点,从而导致更大的开销、副作用与不便,同时却无任何益处可言。
螺内酯
螺内酯是一种抗雄制剂与抗盐皮质激素制剂。在顺性别妇女当中,其作为抗雄制剂广泛用于改善与雄激素相关的头发及皮肤状况——如痤疮、多毛症、脱发、由多囊卵巢综合征(PCOS)引起的高雄激素血症等。其也被女性倾向跨性别者用于激素治疗;其在美国是该群体尤其使用最多的抗雄制剂。
螺内酯在医学上最初的主要用途,是作为抗盐皮质激素制剂用于治疗心衰、高血压、醛固酮(盐皮质激素)增多症、低钾血症,以及肾病综合征、腹水等体液潴留过多的状况,等等(维基百科)。
在抗雄激素活性上,螺内酯有较弱的雄激素受体(AR)拮抗效力与雄激素合成抑制效力(维基百科)。具体而言,对于后者,其通过对 17α-羟化酶与 17,20-裂解酶的抑制作用来发挥效力(维基百科)。
螺内酯并无明显的孕激素活性、直接雌激素活性,也不会抑制 5α-还原酶(维基百科)。不过,在足够高的剂量下,其抗雄效力可能会间接引起雌激素效力(如乳房发育、女性化等)(维基百科)。
在有关顺性别男性、顺性别妇女与女性倾向跨性别者的临床研究中,螺内酯对睾酮水平仅表现出有限、且高度不稳定的作用;其中大多数研究未发现睾酮水平的变化,有的发现其降低了,少数研究甚至发现其升高了(Aly, 2018; Aly, 2020)。尽管如此,上述研究普遍发现,螺内酯在未改变睾酮水平的情况下,仍可产生抗雄效力。因此,雌激素的抗雄激素作用应主要源于其 AR 阻断作用。
有鉴于此,对于以螺内酯作为抗雄制剂使用的女性倾向跨性别者,其处方里可抑制睾酮分泌的可能主要或仅为雌激素。这部分出自有关女性倾向跨性别者的一些研究,其中有的比较单服雌二醇与同时服用螺内酯的疗法(如 Leinung, 2014; Leinung, Feustel, & Joseph, 2018; Angus et al., 2019),有的比较不同剂量螺内酯下的睾酮水平(如 Liang et al., 2018; SoRelle et al., 2019; Allen et al., 2021)。
对于合用雌二醇与螺内酯的女性倾向跨性别者,由于螺内酯对睾酮分泌的影响甚微,故其睾酮水平往往不会被抑制到女性范围,而仍高于之(例如,其平均值达 50-450 ng/dL,合 1.7-15.6 nmol/L)(Leinung, 2014; Leinung, Feustel, & Joseph, 2018; Liang et al., 2018; Angus et al., 2019; Jain, Kwan, & Forcier, 2019; SoRelle et al., 2019; Sofer et al., 2020; Burinkul et al., 2021)。不过,使用此种处方确实能够让睾酮水平随治疗时间而逐渐下降(如 Liang et al., 2018; Sofer et al., 2020, 图表; Allen et al., 2021)。
螺内酯因其较弱的 AR 拮抗效力,故应很适合阻断处于或略高于女性范围的睾酮水平(如 <100 ng/dL,合 <3.5 nmol/L)(Aly, 2018)。此观点来自两部分研究:一部分为不同剂量的螺内酯(多为 50-200 mg/天)用于健康的、和患有 PCOS 的顺性别妇女之临床研究(Goodfellow et al., 1984; Lobo et al., 1985; Hammerstein, 1990; James, Jamerson, & Aguh, 2022);另一部分则将螺内酯与抗雄效力更强的氟他胺进行比较(Cusan et al., 1994; Erenus et al., 1994; Shaw, 1996)。
目前临床上螺内酯对女性倾向跨性别者的抗雄效力评估甚少,故其不甚明了(Angus et al., 2021)。不过,对于顺性别妇女,其在改善与雄激素相关的毛发与皮肤状况上的抗雄效力是有目共睹的;因此只要睾酮水平不高,螺内酯就会很有效(Brown et al., 2009; van Zuuren & Fedorowicz, 2016; Layton et al., 2017; Barrionuevo et al., 2018; James, Jamerson, & Aguh, 2022)。
此外,对于女性倾向跨性别者,高剂量螺内酯(如 300-400 mg/天)应更有助于阻断较高的睾酮水平;现有的跨性别护理指南也对此予以认可(Aly, 2020)。
对于许多女性倾向跨性别者,雌二醇合并螺内酯的处方并不足以抑制其睾酮,因为螺内酯对睾酮水平的影响有限且高度不稳定,其 AR 拮抗效力亦较弱。这样会导致她们的去男性化、女性化、乳房发育等效果不理想。这些效果如使用其它抗雄手段——诸如比卡鲁胺、CPA、GnRH 调节剂与高剂量雌二醇单服疗法等——则应该会更佳;这些手段要么可更高效地阻断雄激素,要么可将睾酮水平降低并稳定于女性范围。
如果合用雌二醇与螺内酯时发现睾酮水平依然过高,则应考虑以下选项:换用另一种抗雄制剂;加大雌二醇剂量;或者加入具有抗促性腺激素效力的孕激素(如非口服孕酮,或合成孕酮制剂)。
螺内酯是一种强效的抗盐皮质激素制剂;或者说,盐皮质激素受体拮抗剂(孕酮同样有抗盐皮质激素效力,但远不及螺内酯的高)。这种受体是醛固酮与 11-去氧皮质酮等盐皮质甾体激素的作用靶点,可起到调节电解质与体液平衡等作用。
螺内酯可适度降低血压;这可视为其抗盐皮质激素活性所带来的益处之一(Martinez-Martin et al., 2022)。
不过尽管螺内酯的耐受性很高,但其有时会因抗盐皮质激素效力而产生一系列副作用,包括:血压过低、头晕、疲倦、尿频、皮质醇水平升高,等等(Kellner & Wiedemann, 2008; Kim & Del Rosso, 2012; Zaenglein et al., 2016; Layton et al., 2017; James, Jamerson, & Aguh, 2022)。
在跨性别社群中有人表示,螺内酯可能会因为抗盐皮质激素活性与皮质醇水平的升高,而引起内脏脂肪含量的升高;然而,目前尚无证据支持这种假设(Aly, TBD)。现有数据亦不支持螺内酯会阻碍女性倾向跨性别者的乳房发育(Aly, 2019),或者产生抑郁等严重的神经性精神副作用(Aly, 2019)。
与螺内酯的抗盐皮质激素活性相关的最大风险,是高钾血症(维基百科)。此并发症很罕见,基本仅见于有特定风险因素的人群;但症状严重,会导致住院以至死亡。这些风险因素包括:
有一项例子可表明利钾药物的相互作用:在老年群体(大于 65 岁)当中,同时服用螺内酯与甲氧苄啶可引起严重高钾血症以及猝死(Antoniou et al., 2011; Antoniou et al., 2015)。
建议有上述风险因素的人群,在以螺内酯进行治疗时应监测血钾水平(对于非风险人群应无必要)(Plovanich, Weng, & Mostaghimi, 2015; Zaenglein et al., 2016; Layton et al., 2017; Millington, Liu, & Chan, 2019; Wang & Lipner, 2020; Gupta et al., 2022; Hayes et al., 2022)。
对于有高钾血症风险的人群,通常建议在饮食中限制富钾食品的摄入量(Roscioni et al., 2012; Cupisti et al., 2018)。这也常在跨性别健康话题当中提及,例如女性倾向跨性别者会被告诫“不要吃香蕉”,因为“香蕉富含钾”。然而,通过限制钾的摄入来预防螺内酯引起的高钾血症,仅有理论可能;事实上,现有数据否定了此法的有效性(St-Jules, Goldfarb, & Sevick, 2016; St-Jules & Fouque, 2021; Babich, Kalantar-Zadeh, & Joshi, 2022; St-Jules & Fouque, 2022)。
因此,可能并无必要在服用螺内酯的同时限制钾的日常摄入。
螺内酯以 25、50、100 mg 等片剂的形式供口服(维基百科)。螺内酯是数种活性代谢物的前体,包括:7α-甲硫基螺内酯、6β-羟基-7α-甲硫基螺内酯、坎利酮(即 7α-脱硫乙酰基-δ6-螺内酯)等;螺内酯及上述三种代谢物的消除半衰期分别为 1.4 小时、13.8 小时、15.0 小时和 16.5 小时(维基百科)。
由于螺内酯及其代谢物维持较高血药水平的时间较短(图表),建议应每日分两次分量服用,而非每日一次;这样疗效也更佳(Reiter et al., 2010)。
比卡鲁胺
比卡鲁胺是一种非甾体类抗雄制剂(NSAA),和一种强效、高选择性的 AR 拮抗剂 (维基)。其主要用于治疗顺性别男性的前列腺癌;这种癌对雄激素敏感,因此抗雄制剂有助于减缓其发展;此用途占到了比卡鲁胺处方的绝大部分(维基)。
除前列腺癌之外,比卡鲁胺还用于治疗以下症状(尽管效力远不及之)(维基):
- 顺性别妇女的多毛症、脱发与 PCOS;
- 顺性别男孩的 外周性早熟*(性早熟的一种罕见形态,GnRH 拮抗剂等抗促性腺激素制剂对其无效);
- 顺性别男性的阴茎异常勃起等。
* 译者注:链接指向的是“家族性性早熟”,是外周性早熟的一种。
比卡鲁胺正被越来越多的女性倾向跨性别者用作抗雄制剂(Aly, 2020; 维基)。然而,其使用范围仍很有限,一些知名的跨性别健康指南亦未推荐使用之(Deutsch, 2016—UCSF 版指南; Coleman et al., 2022—WPATH SOC8)、或者仅慎重地允许使用(Thompson et al., 2021—芬威健康版指南);这是因为目前对于比卡鲁胺用于女性倾向跨性别者以及其潜在风险的研究还很稀缺。尽管如此,在美国,还是有一批医师正在(或打算)为女性倾向跨性别者开出比卡鲁胺;这批医师人数较少,但正日益增长(Aly, 2018)。
迄今已有一项小型临床研究评估了比卡鲁胺用于女性倾向跨性别者的状况;具体而言,是作为青春期阻断剂,用于被保险拒绝垫付 GnRH 拮抗剂费用的一部分青年人(Neyman, Fuqua, & Eugster, 2019)。
比卡鲁胺的 AR 拮抗效力远高于螺内酯与 CPA(维基; Neyman, Fuqua, & Eugster, 2019)。女性倾向跨性别者通常以 25-50 mg/天的剂量服用——不过此剂量基于主观臆断,而非客观数据(Aly, 2018; Aly, 2019)。尽管如此,此剂量下的 AR 拮抗作用依然较强,合用雌二醇时亦可高效抑制睾酮,因此应该适合许多女性倾向跨性别者用于阻断睾酮。
根据一些有关比卡鲁胺单服疗法用于患前列腺癌的顺性别男性的研究,在较高剂量下(超过 50 mg/天),比卡鲁胺可显著阻断处于男性范围的睾酮水平(>300 ng/dL,合 >10.4 nmol/L)(Aly, 2018; Aly, 2019; 维基);这是螺内酯和 CPA 都做不到的。
比卡鲁胺对 AR 的选择性很强,其在女性当中未发生任何脱靶激素活性,也几乎不产生任何副作用(Erem, 2013; Moretti et al., 2018);这点也与螺内酯、CPA 等抗雄制剂相反——此二者会产生抗盐皮质激素活性、强孕激素活性等脱靶效应,以及一系列副作用与风险。
作为选择性 AR 拮抗剂,比卡鲁胺并不会使睾酮水平降低,反而会使其升高;因为其会中断 AR 对促性腺激素分泌的负反馈调节,而(多出来的促性腺激素)会对性腺的睾酮分泌进行补偿性正调节(维基)。然而,比卡鲁胺仍可阻断多出来的这部分睾酮的效力(维基; Aly, 2019)。此外,如若结合比卡鲁胺与一种适当剂量的抗促性腺激素制剂(如雌二醇)使用,则会让睾酮水平不增加、或者增幅变小(Aly, 2018; 维基)。
尽管比卡鲁胺并无其它明显的激素活性,但由其抗雄效力可间接产生一定的雌激素效力(如女性化和乳房发育)(维基; 维基; Neyman, Fuqua, & Eugster, 2019)。
比卡鲁胺不易被接受并用于女性化激素治疗的主要原因之一,是其具有一定健康风险;例如,其有较小的肝毒性与肺毒性等风险(Aly, 2020; 维基; 维基)。
在对早期前列腺癌进行的临床试验当中,有 3.4% 的正进行比卡鲁胺单药治疗的男性出现肝功能指标异常(如肝酶及胆红素水平上升);而使用安慰剂(标准疗法)的男性则有 1.9% 发生异常(维基)。
在(有关比卡鲁胺的)临床试验中,有 0.3-1.4% 的男性因肝功能指标过高、且很可能已造成严重肝中毒,而被迫终止了比卡鲁胺治疗(维基)。
截至目前,已有 10 例由比卡鲁胺引起严重肝中毒、以至死亡的病例公开发表——这 10 例患者均为患前列腺癌的男性(维基; 表格; Aly, 2018)。
此外,还有数例未公开发表的、由比卡鲁胺引起肝衰竭而亡的女性倾向跨性别者病例报告(Aly, 2020)。不过这些报告尚未被确认属实,可能不大可信。
肝功能异常往往在以比卡鲁胺治疗的前 3-6 个月里出现(Kolvenbag & Blackledge, 1996; 经 FDA 批准的 Casodex 药品说明书);所有由比卡鲁胺引起的肝中毒病例皆在治疗前 6 个月里便出现相关迹象(表格)。
已知在临床使用的剂量范围下,比卡鲁胺的肝毒性并不与剂量相关(维基);在顺性别妇女当中,即使是很低的剂量(如 10-50 mg/天)亦足以引起肝功能异常(Aly, 2018)。
出于肝毒性风险的考虑,强烈建议在使用比卡鲁胺时,应定期监测肝功能——尤其是治疗的前 6 个月内。肝中毒的迹象包括:恶心、呕吐、腹痛、疲倦、食欲不振、类似流感的症状、小便黄赤、黄疸(皮肤/眼球发黄)等等(维基)。
至于其肺毒性风险:比卡鲁胺已知与罕见的间质性肺炎相关,后者可导致肺纤维化、以至死亡;其还与更加罕见的嗜酸性肺炎有关(维基; 表格; Aly, 2018)。截至撰稿时,已有 15 例由比卡鲁胺引起的间质性肺炎、2 例由比卡鲁胺引起的嗜酸性肺炎病例报告;这些患者同样皆为患前列腺癌的男性(表格)。
据估计,使用比卡鲁胺引起的间质性肺炎发生率约为每万人 1 例;不过考虑到有病例漏报的可能,实际值可能还会更高(维基; Aly, 2018)。
对于亚洲人种,服用比卡鲁胺及其它 NSAA 时的肺中毒风险可能更高;已知上述症状的发生率在该人种内远超其他人种(Mahler et al., 1996; Wu et al., 2022)。
目前尚无任何实验室指标可供定期监测比卡鲁胺引起的肺脏改变。肺中毒的迹象包括:呼吸困难(或气短)、咳嗽、咽喉炎(通常表现为咽痛)等(维基)。
比卡鲁胺以 50、150 mg 片剂等形式供口服(维基)。当口服剂量超过 150 mg/天左右时,胃肠道对比卡鲁胺的吸收能力开始饱和,生物利用度逐渐下降;到 300 mg/天以上时,血药水平不再随之上升(维基; 图表)。
比卡鲁胺的消除半衰期很长,约达 6-10 天(维基; 图表);因此,其无需每日一服,服药频率可放宽至每周两服、以至一服(如果这样更舒适或者有其它需要的话),单次剂量则随之适当加大(Aly, 2018)。
另外,由于半衰期很长,比卡鲁胺需要 4-12 周左右方可完全达到血清水平的稳态;不过,要达到完全稳态水平的 50% 左右仅需不足一周,而达到稳态水平的 80-90% 左右则需 3-4 周(Aly, 2018; 图表; 维基)。如果需要,可在开始服用比卡鲁胺时采用较大的初始剂量,以更快达到稳态。
动物实验曾表明,比卡鲁胺不会突破血脑屏障(即不会阻断大脑中的 AR),因此其应当是选择性作用于神经末梢的(维基)。然而,后来的临床研究发现其不适用于人类:比卡鲁胺对人类神经中枢表现出明显的抗雄效力(维基)。
诸如氟他胺 (Eulexin) 和尼鲁米特 (Anandron, Nilandron) 等推出更早的 NSAA,具有远高于比卡鲁胺的风险,故不应为女性倾向跨性别者所用。其中,尼鲁米特在早年数项研究里是作为抗雄制剂用于女性倾向跨性别者的,但因其肺中毒发生率很高,且其它副作用明显,故此后不再沿用(Aly, 2020; 维基)。而氟他胺也曾作为抗雄制剂有限应用于女性倾向跨性别者;但因其引起肝毒性的风险远甚于比卡鲁胺,且有其它诸多副作用和不足,故如今不应再使用(Aly, 2020; 维基)。
近年推出的其它强效 NSAA,如恩杂鲁胺(Xtandi)、阿帕鲁胺(Erleada)与达洛鲁胺(Nubeqa)等,亦具有上述风险,且基本仅用于(或被研究用于)前列腺癌;不过达洛鲁胺在将来可能有望成为女性倾向跨性别者的一个抗雄制剂选项。
5α-还原酶抑制剂
睾酮可在体内某些组织通过 5α-还原酶转化为二氢睾酮(DHT)(Swerdloff et al., 2017);DHT 是睾酮的一种代谢物,其雄激素活性比睾酮高几倍。人体内有 5α-还原酶的组织有限,主要包括皮肤、毛囊和前列腺。虽然 DHT 的效力高于睾酮,但它鲜少进入到血液循环并发挥作用(Horton, 1992; Swerdloff et al., 2017);相反,睾酮是主要的血清雄激素,而 DHT 的作用被认为主要通过在特定组织内部由睾酮代谢并增强而来。
诸如非那雄胺(Proscar, Propecia)、度他雄胺(Avodart)等 5α-还原酶抑制剂(5α-RI)可抑制 5α-还原酶,从而阻止睾酮转化为 DHT;这使得 DHT 在血液和组织内的水平明显下降。由于 DHT 在组织内的作用是一种媒介、而非血清激素,因此 5α-RI 的抗雄激素效力有限。这体现在它们在顺性别男性中的耐受性很好,且未引起明显的去男性化作用(Hirshburg, 2016)。
5α-RI 的医学用途主要限于治疗脱发,以及女性的多毛症 (面部/身体毛发过多) 和男性的前列腺肥大。其大概也可治疗女性痤疮,但相关证据稀缺(维基)。出于以上特质,5α-RI 并不适合作为一般的抗雄激素用于女性倾向跨性别者。
此外,对女性倾向跨性别者的激素治疗而言,在抑制睾酮分泌、使睾酮水平下降的同时,DHT 水平也会一并下降;如睾酮水平已处于女性范围,那么此时再服用 5α-RI,应当说用处不大,而且也无必要(Gooren et al., 2016; Irwig, 2020; Prince & Safer, 2020; Glintborg et al., 2021);不过,如果有持续的体毛生长或脱发,那么 5α-RI 对其应该有用——这点已为顺性别妇女所佐证(Barrionuevo et al., 2018; Prince & Safer, 2020)。然而,需要指出,有证据表明 AR 拮抗剂对这类情况的效力更佳(van Zuuren et al., 2015);这点是显而易见的,因为 AR 拮抗剂可同时阻断睾酮和 DHT 作用,而 5α-RI 仅阻止睾酮到 DHT 的转化过程。因此,尽管 5α-RI 可大幅降低以至清除 DHT、从而仅发挥抗雄效力,但其并不会降低睾酮水平、反而会增加之。
5α-还原酶有三种亚型。度他雄胺可抑制 5α-还原酶的所有三种亚型,而非那雄胺只抑制其中的两种。因此,度他雄胺是一种表现比非那雄胺更全面的 5α-RI。
度他雄胺可使血液中的 DHT 水平降低 98%,而非那雄胺只能降低约 65% 至 70%。鉴于几乎所有血清 DHT 都来自外周组织,这些降幅表明组织中 DHT 的产生也在减少(Horton, 1992)。度他雄胺已知在治疗男性脱发上的效力高于非那雄胺,这于上述发现吻合(Zhou et al., 2018; Dhurat et al., 2020; 维基)。
出于上述原因,尽管非那雄胺和度他雄胺都很有效,但如要使用 5α-RI,应优先考虑度他雄胺 (Zhou et al., 2018; Dhurat et al., 2020)。
对于女性倾向跨性别者,5α-RI 有一项潜在不良影响:在睾酮分泌未被充分抑制的情况下,其可能会一定程度上增加血清睾酮水平(Leinung, Feustel, & Joseph, 2018; Aly, 2019; Traish et al., 2019; Irwig, 2020; Glintborg et al., 2021)。
在睾酮水平低于男性正常范围的受试者当中,DHT 似乎可大大增加对垂体促性腺激素分泌的负反馈作用(Traish et al., 2019)。这对女性倾向跨性别者的治疗意义(如有)尚不明确。
5α-RI 还有另一个潜在不良作用:其不仅抑制 DHT 的产生,还会抑制某些神经甾体的产生。神经甾体是作用于神经系统的类固醇——特别是大脑。被 5α-RI 抑制合成的神经甾体包括:别孕烷醇酮(由孕酮形成)与 3α-雄烯二酮(由睾酮和 DHT 衍生)。研究表明,这些神经甾体在情绪、焦虑、压力和其它认知/情感过程中具有重要的生物调控作用(King, 2013)。已知 5α-RI 与轻微的抑郁症风险有关,这可能与上述吻合(Welk et al., 2018; Deng et al., 2020; Dyson, Cantrell, & Lund, 2020; Nguyen et al., 2020; 维基)。
此外还有一些说法,认为 5α-RI 有其它更显著、更持久的副作用,例如“非那雄胺戒断综合征”(PFS)(Traish, 2020);然而,作为其依据的报告质量很低,且存在争议(Fertig et al., 2016; Rezende, Dias, & Trüeb, 2018)。
反安慰剂效应也可能导致了对 5α-RI 之副作用的看法恶化(Kuhl & Wiegratz, 2017; Maksym et al., 2019; Aly, 2020)。
临床剂量范围研究发现,即使以低于常规的剂量,非那雄胺和度他雄胺仍可相当程度或接近最大程度地抑制 5α-还原酶(Gormley et al., 1990; Vermeulen et al., 1991; Sudduth & Koronkowski, 1993; Drake et al., 1999; Roberts et al., 1999; Clark et al., 2004; Frye, 2006; Olsen et al., 2006; Harcha et al., 2014; Kuhl & Wiegratz, 2017)。
例如,在一项使用非那雄胺的研究中,(血清)DHT 水平在 0.05mg/天、0.2mg/天、1 mg/天和 5 mg/天的剂量下分别下降 49.5%、68.6%、71.4% 和 72.2%;在头皮内亦观测到了 DHT 水平的同步降低(Drake et al., 1999)。
在另一项使用度他雄胺的研究中,DHT 水平在 0.05mg/天、0.5mg/天、2.5 mg/天和 5 mg/天的剂量下分别下降 52.9%、94.7%、 97.7% 和 98.4% (Clark et al., 2004)。
基于上述发现,如果需要,应可在较低剂量下服用 5α-RI,以便节约药费。非那雄胺片剂可被切分来减小剂量。度他雄胺无法照做,因为其剂型是油胶囊;不过其半衰期很长,故可通过减少用药频率(如每几日一服)来减小剂量。
5α-还原酶抑制剂以片剂和胶囊的形式供口服。此外也有非那雄胺的外用复合剂型;不过需要注意,这种剂型已知会导致摄入过量,且其对全身 DHT 的抑制作用与口服剂型相当(Marks et al., 2020)。另一方面,浓度更低的非那雄胺外用制剂可能更多地作用于局部(Marks et al., 2020)。
表 7:可用于女性倾向跨性别者的 5α-还原酶抑制剂和推荐剂量:
| 药品 |
途径 |
形式 |
剂量 |
| 度他雄胺 |
口服 |
胶囊 |
0.05–2.5 mg/天 |
| 非那雄胺 |
口服 |
片剂 |
0.05–5 mg/天 |
GnRH 激动剂和拮抗剂
GnRH 激动剂和拮抗剂 (GnRHa)——或者说,GnRH 受体激动剂/拮抗剂,或 GnRH 调节剂——,通过阻断 GnRH 在脑垂体的作用、从而抑制 LH 和 FSH 的分泌,来发挥抗雄效力。
通常来说,受体激动剂会激活受体,而受体拮抗剂阻断受体、使其无法被激活;不过 GnRH 激动剂与拮抗剂对脑垂体的作用竟完全一致。这是由一种生理怪象所致——即在通常生理条件下,GnRH 会以间歇式分泌,但当脑垂体中的 GnRH 受体被外源性激动剂反常地持续激活时,其敏感度会大幅降低、以至不再被激活。因此,GnRH 激动剂与拮抗剂均可起到停止性激素从性腺的分泌之作用;在受试者当中,其皆可将睾酮水平降至已去势或女性正常范围(<50 ng/dL,或 <1.7 nmol/L)。GnRHa 有些像是可逆的去势手段,因此有时也被称为“药物去势”。
已知 GnRHa 在与雌激素合并服用以防止性激素不足时,基本没有任何副作用或风险;因此,GnRHa 是最适合女性倾向跨性别者使用的抗雄制剂。
GnRHa 广泛用于阻断青少年跨性别者的青春期。不过很遗憾,其费用非常高昂(可达每年一万美元左右),而成年跨性别者往往会被医保拒绝垫付其费用;因此 GnRHa 目前并不常为成年女性倾向跨性别者所用。
英国在这方面属于例外:在此所有成年跨性别者所用 GnRH 激动剂皆可得到英国全民医疗服务(NHS)的垫付。部分东欧国家亦属于例外:近年来,在那里的网上药店已可以非常低廉的价格购得布舍瑞林 (Suprefact) 鼻腔喷雾剂(Aly, 2018)。
GnRH 激动剂在治疗开始时会引起睾酮水平的短暂暴涨(维基)。在治疗头一周左右,睾酮水平会增加 1.5-2 倍,此后开始下降;一般在 2-4 周内可达到已去势或女性范围(维基)。
相比之下,GnRH 拮抗剂并不会引起睾酮水平的暴涨,后者自服药起便开始下降,数日内即达到已去势范围(维基);这是因为,其不会在一开始激活 GnRH 受体,而会阻断之,从而无需等待受体敏感度下降。
如需要防止或削弱开始服用 GnRH 激动剂时引起的睾酮水平暴涨,可使用抗促性腺激素制剂(如雌激素、孕激素),或者强效的雄激素受体拮抗剂(如比卡鲁胺)(维基)。
GnRH 激动剂与拮抗剂的种类及用法有:
-
阿巴瑞克与地加瑞克——最早研发的几种 GnRH 拮抗剂,每月皮下或肌肉注射一次;
-
恶拉戈利与瑞格列克——近年研发并引入医疗用途的 GnRH 拮抗剂,每日口服 1-2 次。
表 8:可用于女性倾向跨性别者的 GnRH 激动剂和推荐剂量:
| 药品 |
品牌 |
途径 |
形式 |
剂量 |
| 布舍瑞林 |
Suprefact 等 |
皮下注射 |
溶剂 |
200 μg/天(1)
|
|
|
|
植入体 |
6.3 mg/两个月;
9.45 mg/三个月 |
|
|
鼻腔 |
喷雾 |
400 µg 3次/天(2)(3)
|
| 戈舍瑞林 |
唑拉地尔 (Zoladex) |
皮下注射 |
植入体 |
3.6 mg/月;
10.8 mg/3 月 |
| 组胺瑞林 |
Supprelin LA, 梵塔斯 (Vantas) |
皮下植入 |
植入体 |
50 mg/年 |
| 亮丙瑞林 |
Lupron 等 |
肌肉注射 |
溶液 |
1 mg/天 |
|
Eligard、Lupron Depot 等 |
肌肉或皮下注射 |
悬浮液 |
3.75–7.5 mg/月;
11.25–22.5 mg/三个月;
30 mg/四个月;
45 mg/六个月 |
|
维阿杜尔 (Viadur) |
皮下植入 |
植入体 |
65 mg/年 |
| 那法瑞林 |
西纳雷尔 (Synarel) |
鼻腔 |
喷雾 |
400–600 μg 2–3次/天 |
| 曲普瑞林 |
癸吡胺 (Decapeptyl), Trelstar Depot/LA |
肌肉注射 |
悬浮液 |
3.75 mg/月;
11.25 mg/三个月 |
(1) 第一周每日三次 500 μg,之后 200 μg/天。
(2) 第一周每日三次 800 μg,之后每日三次 400 μg。
(3) 可用每日两次 500 μg 替代,但效力更低;睾酮水平降低 70%(至约 180 ng/dL 或 6.2 nmol/L)而非 90%。此数据引自有关布舍瑞林治疗前列腺癌的现有研究结果(Aly, 2018; 维基)。
表 9:可用于女性倾向跨性别者的 GnRH 拮抗剂和推荐剂量:
| 药品 |
品牌 |
途径 |
形式 |
剂量 |
|
阿巴瑞克 (Abarelix) |
Plenaxis |
肌肉注射 |
悬浮液 |
113 mg/月 |
|
地加瑞克 (Degarelix) |
Firmagon |
皮下注射 |
溶液 |
80 mg/月(1)
|
|
恶拉戈利 (Elagolix) |
Orilissa |
口服 |
片剂 |
150–200 mg 1–2x/天(2)
|
|
瑞格列克 (Relugolix) |
Relumina |
口服 |
片剂 |
20-120 mg/天(3)
|
(1) 第一个月使用 240 mg,此后每月 80 mg。
(2) 每日一次 150 mg 并不及每日两次 200 mg 有效(后者在顺性别女性中可最大程度地抑制性激素从性腺的分泌)(维基)。
(3) 在 80-120 mg/天的剂量下可最大程度地抑制性激素从性腺的分泌;而 20-40 mg/天的抑制作用较大、但不充分(MacLean et al., 2015; DailyMed)。
其它激素类药物:雄激素和蛋白同化甾体
除了雌激素、孕激素和抗雄制剂外,雄激素/蛋白同化甾体 (AAS) 有时也被用于女性化激素治疗中;这是当睾酮水平较低 (如低于女性平均水平 30 ng/dL,或 1.0 nmol/L),需要雄激素替代时所用。
有人提出,适当水平的睾酮可能会带来一些好处,如增加性欲、改善情绪和活力、对皮肤健康和皮下脂肪团产生积极影响(Avram, 2004),以及增加肌肉大小和力量(Huang & Basaria, 2017)。然而,对于上述益处,目前没有足够的临床证据支持;而且雄激素可在顺性别妇女当中产生一系列不良效应,包括痤疮、多毛症、脱发与男性化等(维基)。
尽管如此,如女性倾向跨性别者需要采取雄激素替代治疗,那么可选用睾酮、睾酮酯(如脱氢表雄酮,DHEA)和诺龙酯(如癸酸诺龙,ND)等等(Aly, 2020)。
治疗过程中的健康监测
接受激素治疗的女性倾向跨性别者应定期通过血检等方式对治疗效力进行评估,或对治疗安全性进行监测。其中应监测的有:
-
血清雌二醇水平和总睾酮水平——评估治疗的有效性(即激素水平是否处于顺性别妇女的正常范围),并确定是否需要调整用药。
可以监测的有:
另针对不同用药情况,还需定期监测的有:
- 血清肝功能指标,例如天冬氨酸转氨酶(AST)、谷丙转氨酶(ALT)水平等——在使用比卡鲁胺或高剂量 CPA(≥20 mg/天)时,用以监测肝毒性。
- 血钾水平——在服用螺内酯、且有高钾血症相关风险因素时需要(Plovanich, Weng, & Mostaghimi, 2015; Zaenglein et al., 2016; Layton et al., 2017; Millington, Liu, & Chan, 2019; Wang & Lipner, 2020; Gupta et al., 2022; Hayes et al., 2022)。
- 高钾血症风险因素包括:高年龄、肾功能减退、与其它利钾药物或钾补剂合用等。
- 对于无以上风险的健康年轻人,监测血钾的必要性应该不大。
- 血清泌乳素水平——在服用高剂量雌激素或孕激素(尤其是 CPA)时,用以监测高泌乳素血症与泌乳素瘤(Aly, 2020)。
-
核磁共振扫描(MRI)——在服用高剂量 CPA(>12.5 mg/天)时,用以监测脑膜瘤的发展(Aly, 2020)。
如以上指标出现异常,应视其状况与严重性,降低用药剂量或者停用特定药物、以其它药物替代。
某些治疗状况可能导致验血结果不准确。例如,当使用口服孕酮时,以免疫分析法测定的孕酮水平会错误地偏高,因为此法会与孕酮的代谢物(如别孕烷醇酮)发生交叉反应;故其不宜采用,而应改用基于质谱的测定法(Aly, 2018; 维基百科)。不过,如使用非口服途径的孕酮,那么两种测定法皆适用于孕酮水平的测定。
此外,服用高剂量生物素(即维生素 B7)补剂会对免疫分析法测定激素水平的准确性造成干扰,使结果错误偏低或偏高(Samarasinghe et al., 2017; Avery, 2019; Bowen et al., 2019; FDA, 2019; Luong, Male, & Glennon, 2019)。
又如,透皮雌二醇剂型用于手臂时,可对自该手臂采集的血液造成污染,并使得雌二醇水平测量值错误偏高(Vihtamäkia, Luukkaala, & Tuimala, 2004)。
某些癌症已知对激素敏感,其发生率也会受激素治疗影响。在此建议女性倾向跨性别者进行乳腺癌与前列腺癌的筛查(Sterling & Garcia, 2020; Iwamoto et al., 2021)。
其中,乳腺癌风险会随女性化激素治疗(可能尤其是孕激素的使用)而大幅上升;不过,此风险依然会低于顺性别妇女(Aly, 2020)。
而前列腺癌的发生率会因女性倾向跨性别者的激素治疗引起雄激素缺少而显著下降,不过该风险未完全消除,仍有发生的可能(de Nie et al., 2020; Sam, 2020)。前列腺不会随阴道再造术而摘除,因此即使在术后也需对前列腺癌进行监测。
睾丸癌已知不对激素敏感;在接受激素治疗的女性倾向跨性别者当中,其发生率并不会提高(Bensley et al., 2021; de Nie et al., 2021; Jacoby et al., 2021)。
译文修订历史
- 2021 年 6 月 23 日——初次翻译。
- 2022 年 11 月 3 日——第一次全面修订 增补大量新内容,尤其药物详解与健康监测;尝试改善译文质量;修复、调整、优化多处格式与排版;更新多处数据;整理外链;等等。
- 2022 年 11 月 23 日——补足关于氟他胺和尼鲁米特的遗漏部分;继续整理外链。
- 2022 年 11 月 28 日——移除已删除的站内原文链接。



 我也活着
我也活着